序章

図1.ニワトリのギナンドロモルフ Courtesy of the Roslin Institute, The University of Edinburgh, Dr. M.Clinton -

図2.オナシシロオビアゲハのギナンドロモルフ。向って左半分がオス。右半分がメス。下図はその蛹の抜け殻。左右が微妙に異なっている。 豊橋市自然史博物館蔵 
図3.ベルディー二《ヘルマプロディトス》 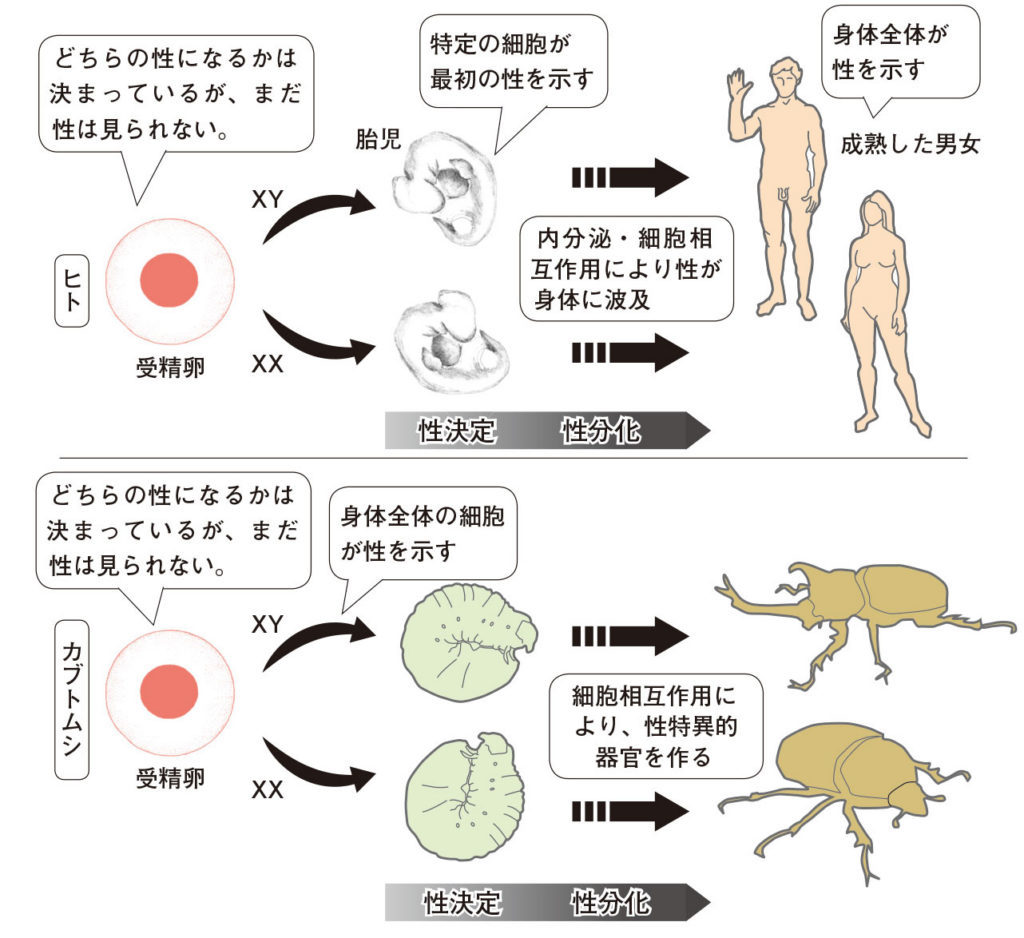
図4.性決定と性分化 ヒトのような脊椎動物ではまず一群の細胞で性が決まり、その後、内分泌作用などで全身の性が分化する。カブトムシのような昆虫では、全身の細胞で遺伝子作用により性が決まる場合が多い。 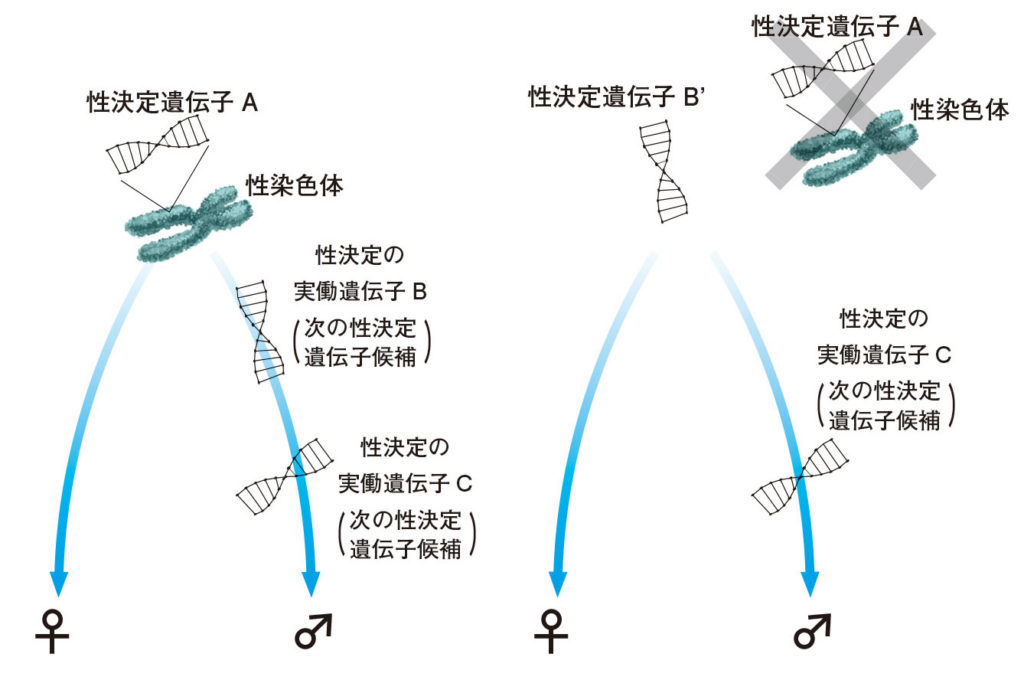
図6.現在の性を決める遺伝子の背後に、次に性決定遺伝子になり得る遺伝子が控えている 
図5.同じエリマキシギでありながら、形の異なる3種のオスがいる (詳しくは第5章) 
図5.同じエリマキシギでありながら、形の異なる3種のオスがいる (詳しくは第5章) 
図5.同じエリマキシギでありながら、形の異なる3種のオスがいる (詳しくは第5章)
第1章:雌雄はどのように作られるか

図1.左は正常オス(XY)のマウス、右はSRY遺伝子をメスに導入したマウス Nature (1991) 351, 117–121. Courtesy of Dr. R. Lovell-Badge 
図2.スティーブンス女史 
図3.ゴミムシダマシ (Tenebrio molitor) 
図3.スティーブンス女史がX染色体について記した論文とそこに記されたスケッチ(上) 
図4.モルガン博士および図5.モルガン博士からスティーブンス女史への献辞 
図6.メダカ卵巣中の生殖細胞の染色体像。ギムザ染色。 撮影:菊地真理子 
図7.前350〜340年頃の皿に描かれたキメラ 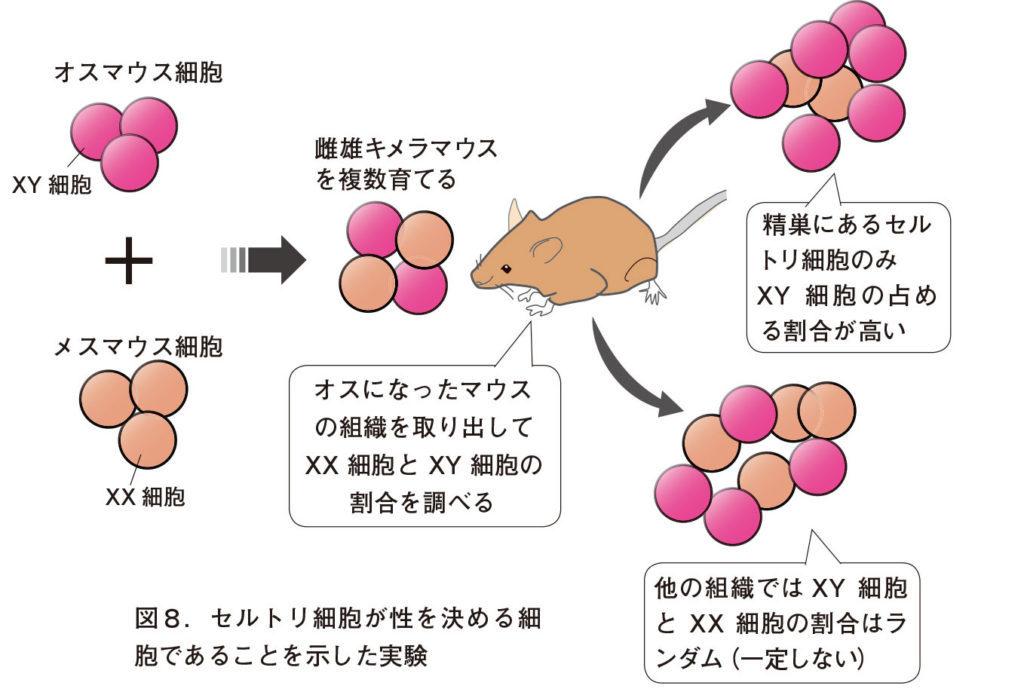
図8.セルトリ細胞が性を決める細胞であることを示した実験 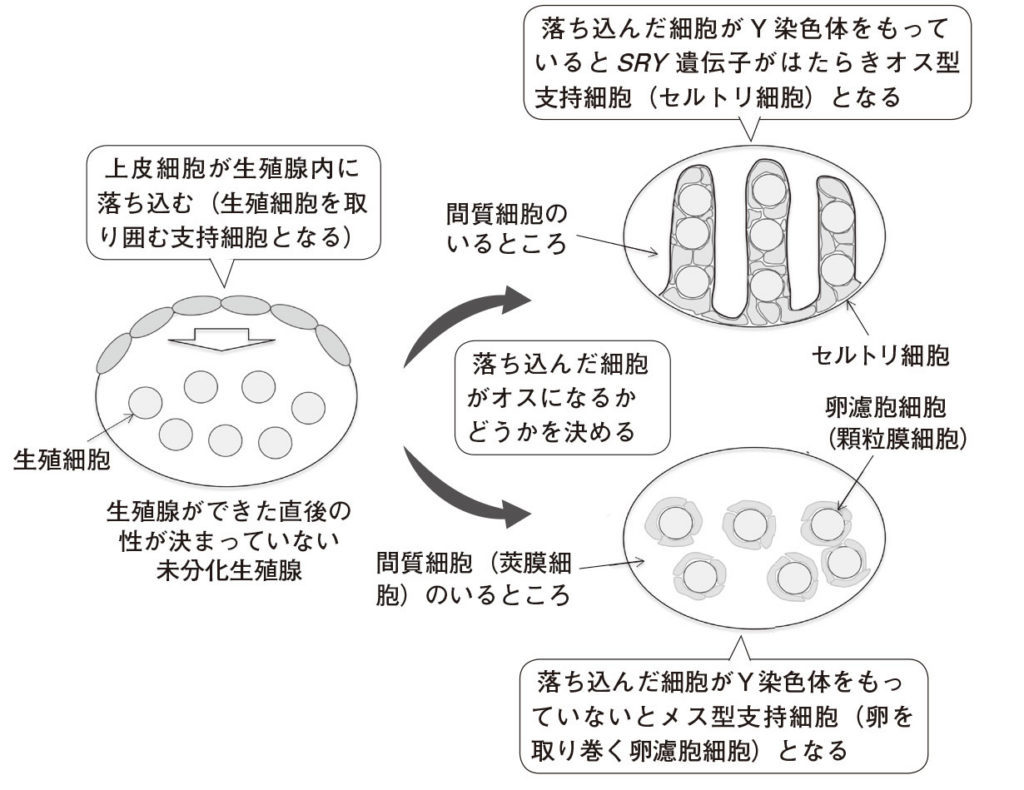
図9.支持細胞でSRY遺伝子が働くか否かで、精巣になるか卵巣になるかが決まる 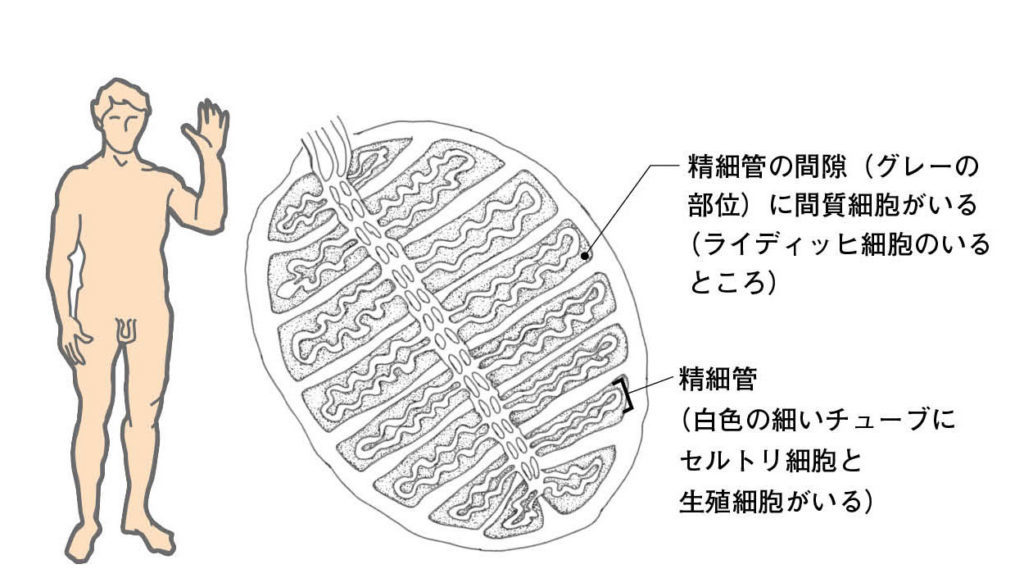
図10.成熟した精巣の模式図 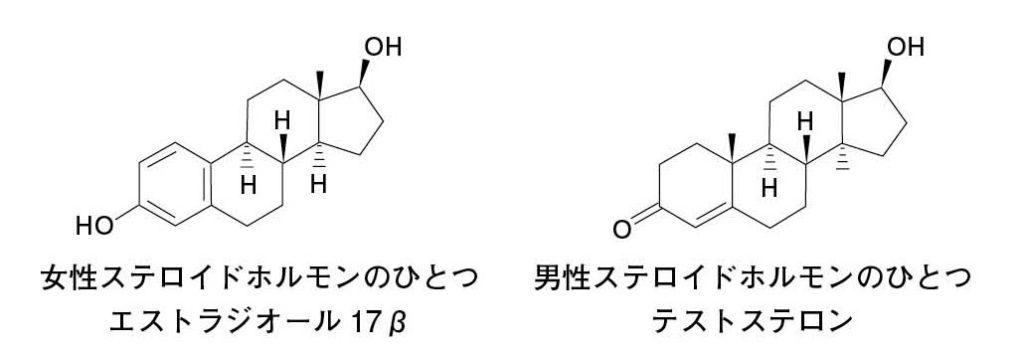
図11.哺乳類に代表的な性ステロイドホルモン 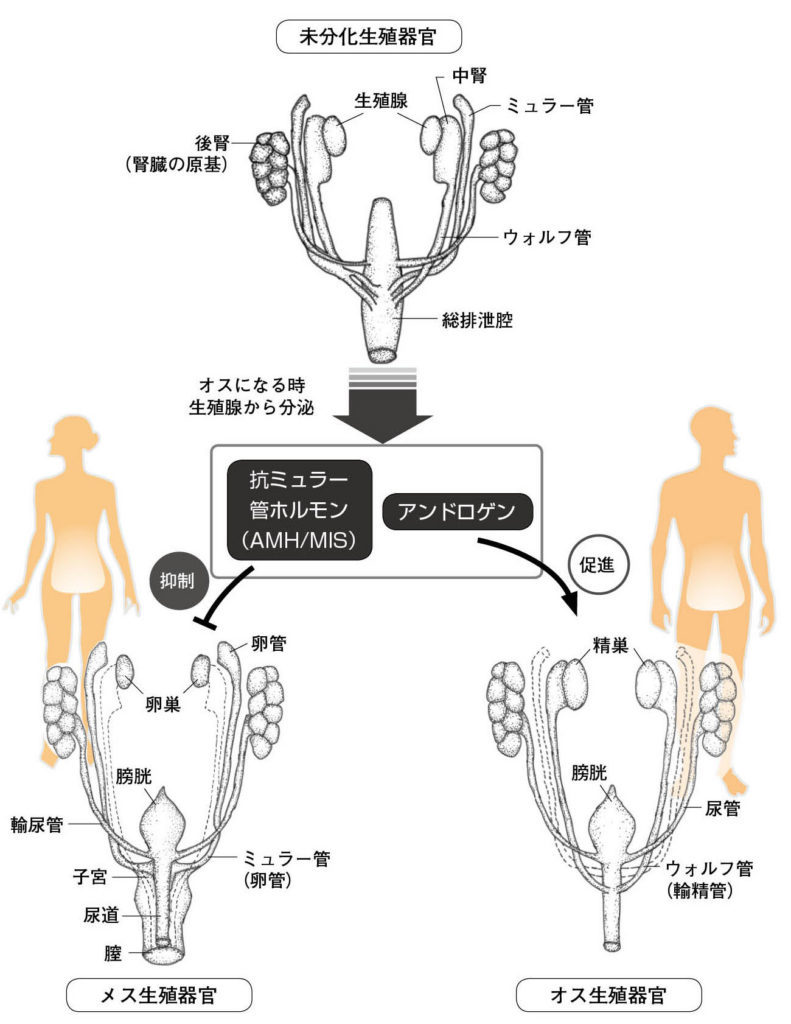
図12.生殖器官の性分化 Developmental Biology, Gilbert 著 より 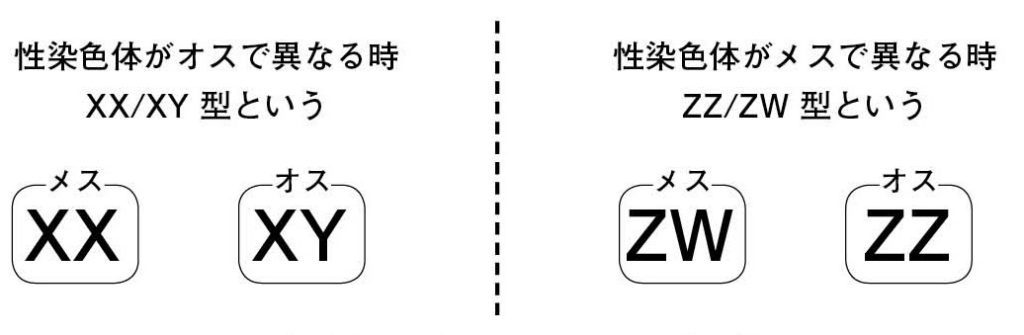
図13.性染色体の形の違いによる性決定様式 
図14.アカミミガメ 撮影:宮川信一 
図15.ミシシッピーワニ 撮影:田中実 
図16.ヨーロッパシーバス illustrated by Jonathan Couch (1789-870) by Freshwater and Marine Image Bank 
図17.フトヒゲアゴトカゲ 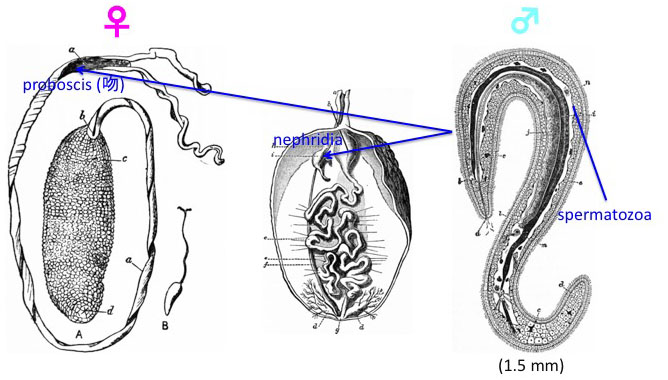
図18.左はボネリムシのメスの全体像。吻の中の nephridia (中図)にオスのボネムリムシ(右図)が存在している。 Encyclopedia Britannica, vol.8 (1911)より 
図19.アワブネガイ 
図20.性転換する魚 オキナワベニハゼ (小林靖尚) 
図20.性転換する魚クマノミ(中村將) 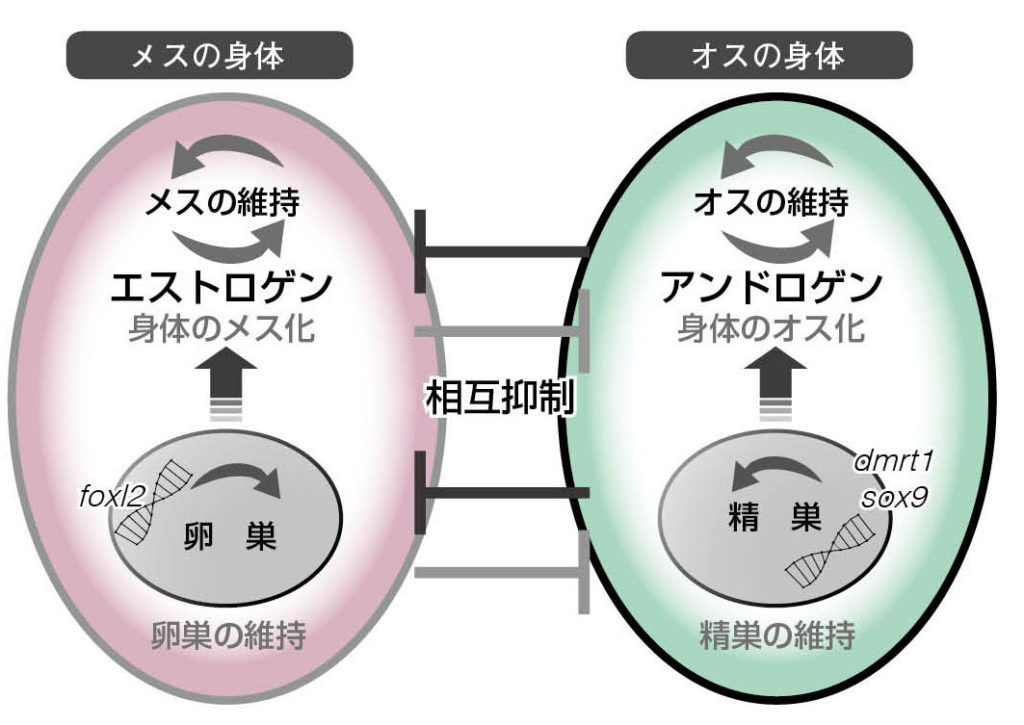
図21.性が維持されることと、もう一方の性に転換してしまうこととは、表裏一体の関係。オスとメスは生殖腺と性ホルモンのふたつのレベルで相互抑制。
第2章:魚の性

図1. メダカ(Oryzias latipes) 実験で用いられているCab と呼ばれる系統。体色はヒメダカと同様赤っぽい。左がメス。右がオス。腹鰭のかたちがオスは平行四辺形。 
図2.日本育種学会会報(第一号第一巻) 1916年に出版。メダカの体色が交配によってどう変化するかが、挿絵とともに記されている。 提供:日本育種学会 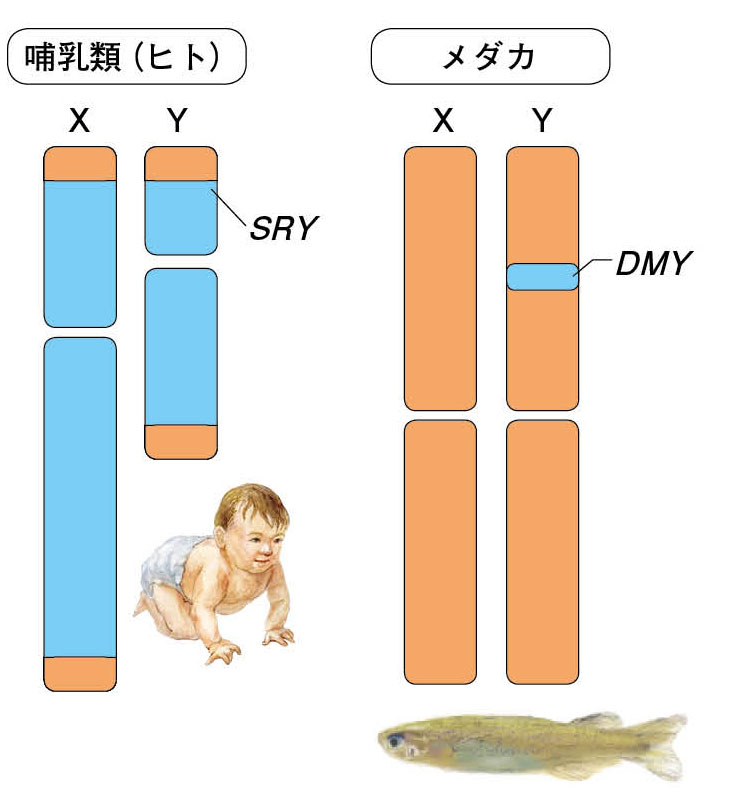
図3.哺乳類とメダカの性染色体の違い 哺乳類ではX と Y 染色体とでは大きく異なるが、メダカは性決定遺伝子が存在する小さな領域以外は X と Y 染色体は同じとされている。濃いグレーの領域がX と Y 染色体で異なる配列を持つ領域。 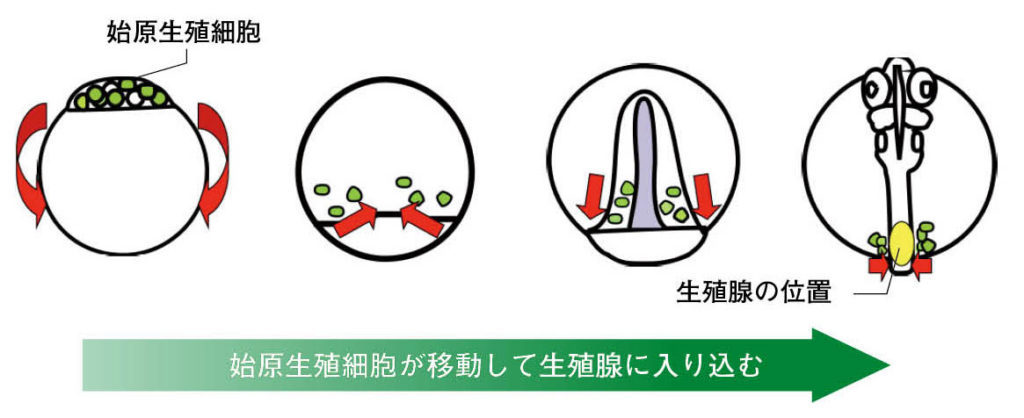
図4.メダカの発生における始原生殖細胞の移動。矢印は始原生殖細胞の移動方向を示し、最終的に未分化生殖腺の中に入り込む。 文献3より改変 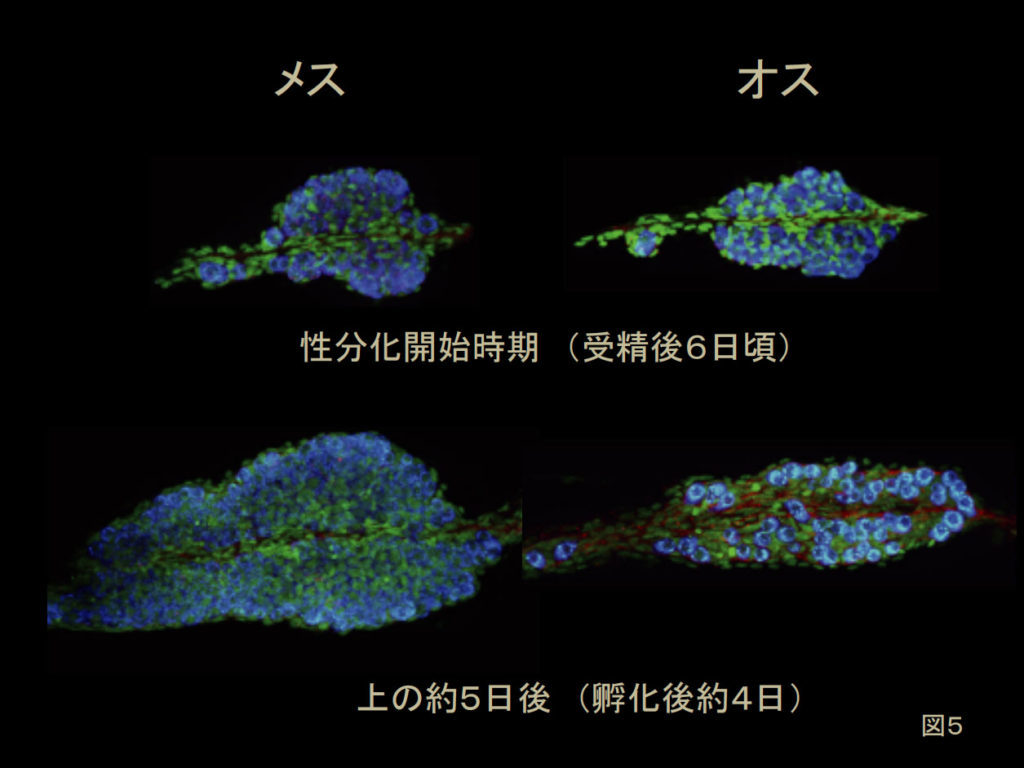
図5.メダカ生殖腺の性分化 発達中の生殖腺を腹側から共焦点レーザー顕微鏡で観察した像。白っぽい色が生殖細胞。薄いグレーがほかのすべての細胞。生殖腺の性分化が開始した直後は雌雄で大きな違いはない。しかしメスの生殖腺は、タイプII分裂型の生殖細胞の数を増やして卵胞も形成され、オスの生殖腺より大きくなる。 文献4より改変 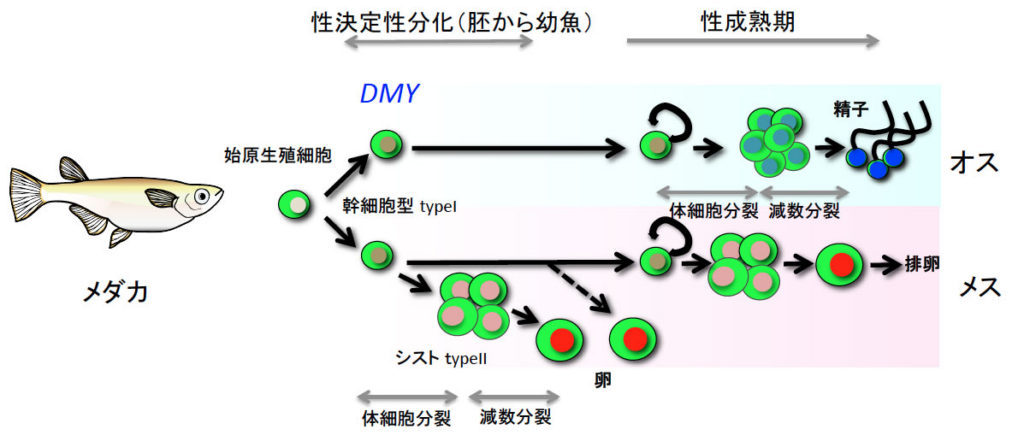
図7.メダカの性分化で生殖細胞がどのように変化するのかを示した図 DMYが発現した時が性決定開始。始原生殖細胞は幹細胞型生殖細胞に分化する。オスではこの細胞はほとんど分裂しないが、メスではシスト型生殖細胞が幹細胞型生殖細胞から分裂して出現する。このシスト型生殖細胞は減数分裂を経て卵となる。オスは性成熟期までシスト型生殖細胞は出現しない。 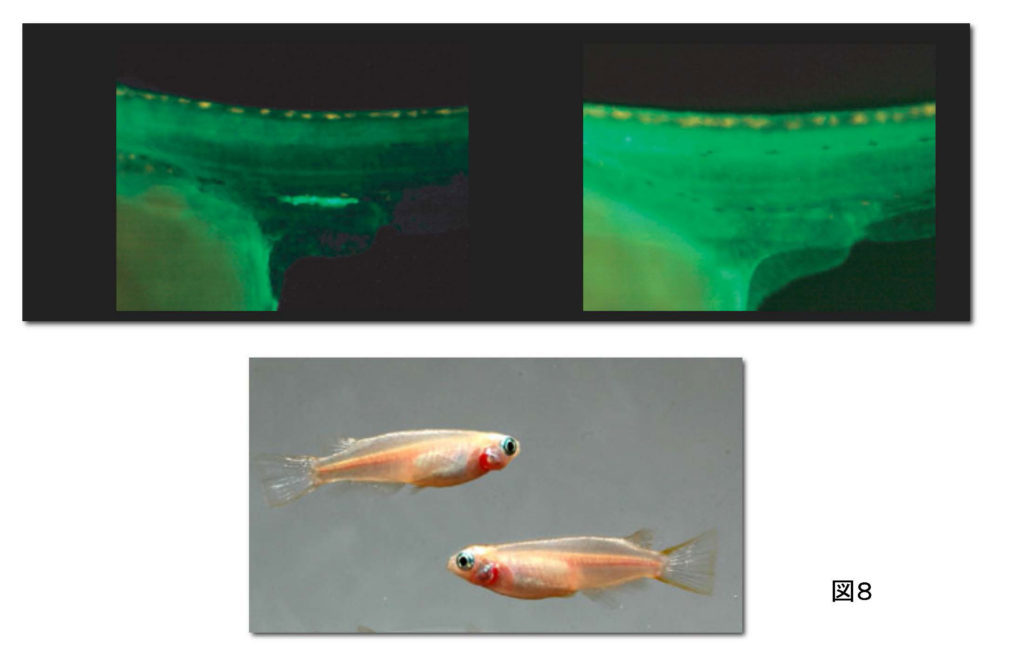
図8.上図:生殖細胞が緑蛍光で光るトランスジェニックメダカの孵化数日後の幼魚の腹部を横から見た図。左図の明るく見えるところが生殖細胞がかたまって存在している生殖腺の位置。右図ではその位置に明るい蛍光が見えず、生殖細胞が生殖腺にいないことを示している。 下図:上図右の幼魚が成熟した時の写真。性分化の時期に生殖腺に生殖細胞が存在していなかったため、Y染色体を持っていないにもかかわらず、オス型の第二次性徴を示している(腹鰭が平行四辺形)。 
図9.幹細胞型生殖細胞が異常に増殖するメダカの突然変異体 hotei 生殖細胞の数が多くなるため、Y染色体(性決定遺伝子DMY)を持っていたとしても多くがメスになる。膨らんだお腹は、生殖細胞が多くなったために巨大化した生殖腺(卵巣)で占められている。興味深いことに、卵巣はガンや腫瘍になったのではなく機能的であり、受精可能な卵や精子を作れる。 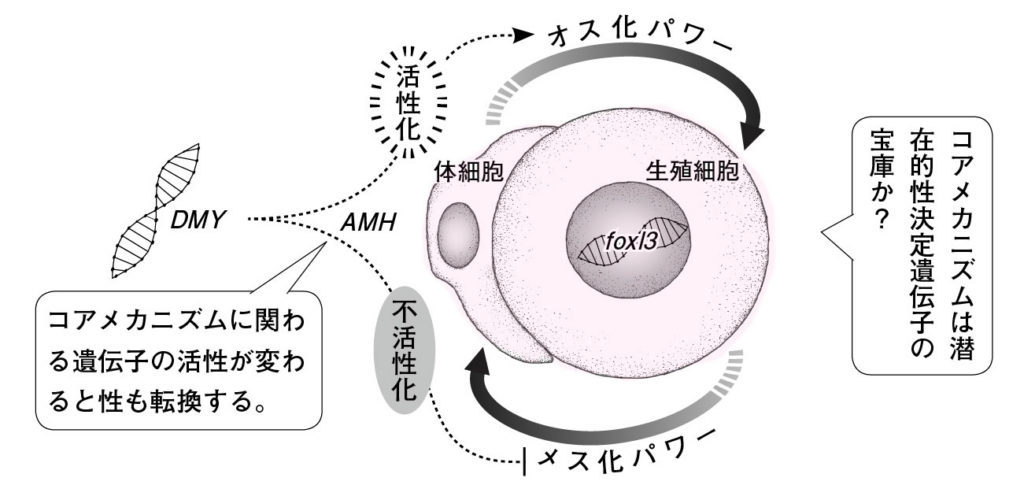
図10.生殖細胞はメス化パワーを持ち、体細胞はオス化パワーを持つ。メダカはこのふたつのパワーバランスで性が決まる。通常のオスでは性決定遺伝子が発現する結果、生殖細胞の数が少なくなり、オス化パワーが増大すると考えられる。性決定遺伝子の有無によらずに性を決めることができるため、このパワーバランスをメダカにおける性のコアメカニズムと呼ぶ。foxl3は性の決まっていない生殖幹細胞の中で働き、生殖幹細胞が精子を作り出すか、卵を作り出すかを決めるスイッチ遺伝子。 
図19.ハワイ産のベラ(Thalassoma duperrey) photo by Bethany Weeks 
図18.オキナワベニハゼ(Trimma okinawae) photo by Klaus Stiefel 
図17.他の魚の体表を掃除するホンソメワケベラ(Labroides dimidiatus) photo by Richard Ling 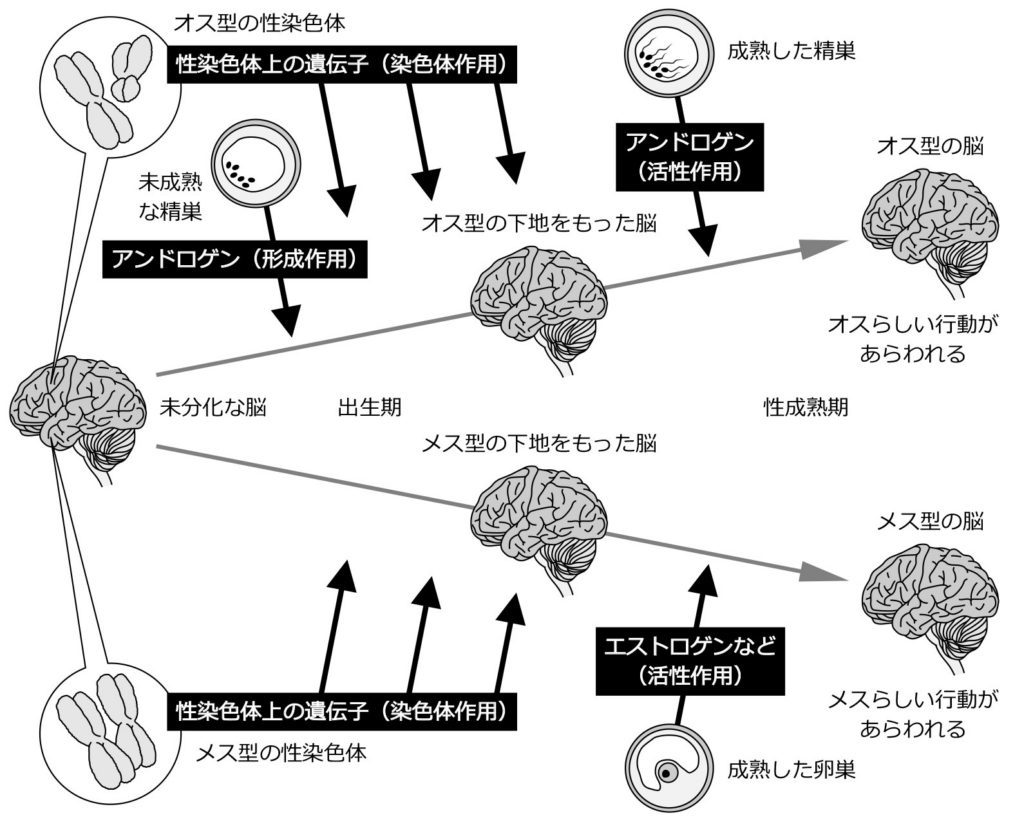
図15.哺乳類の脳が性分化する仕組み 出生前後の時期に、精巣から一時的に大量のアンドロゲンが放出される。脳がそのアンドロゲンにさらされると、脳にはオス型の下地が形成される(この際のアンドロゲンの作用を形成作用とよぶ)。精巣をもたず、アンドロゲンの形成作用を受けないメスの脳には、メス型の下地が型性されることになる。性成熟期になると、精巣からはアンドロゲンが、卵巣からはエストロゲンなどが大量に放出されるようになる。それらの性ステロイドホルモンが脳に届くと、出生期にできあがったオス型の下地、メス型の下地を活性化して、実際に様々なオスらしい行動やメスらしい行動を引き起こす(この際の性ステロイドホルモンの作用を活性作用とよぶ)。また、雌雄それぞれの性染色体上の遺伝子が脳内で発現し、性ステロイドホルモンとは関係なしに、脳を自律的に性分化させる仕組みも存在する(この作用を染色体作用とよぶ)。 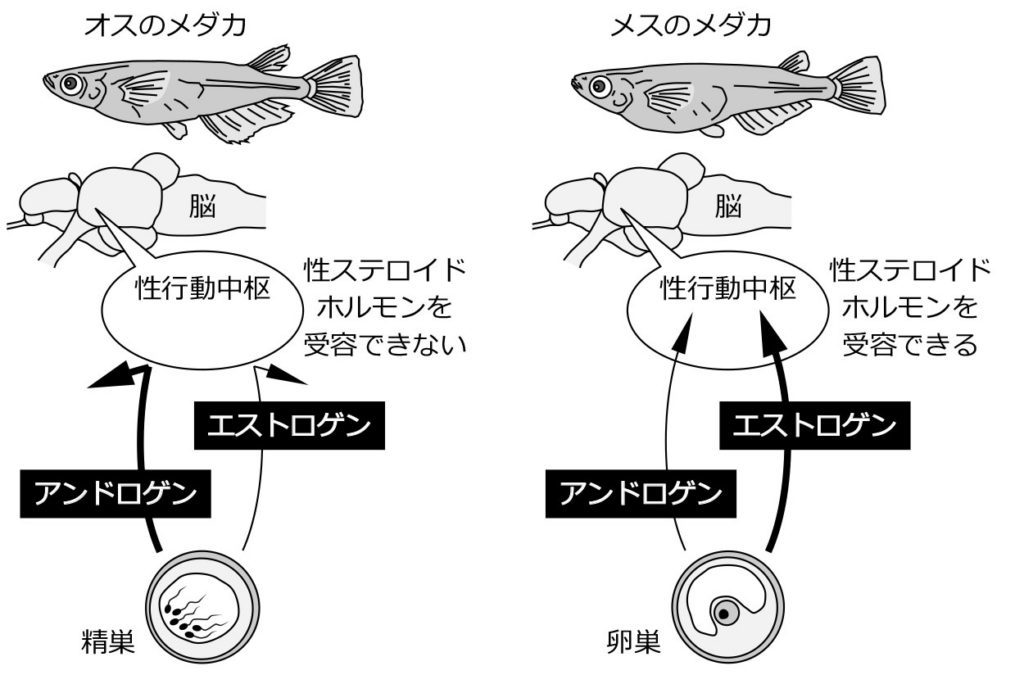
図16.メダカの性行動中枢の性差 メスの性行動中枢には性ステロイドホルモンの受容体が発現しているが、オスの性行動中枢には性ステロイドホルモンの受容体は発現していない。そのため、メダカの性行動中枢は、メスだけが性ステロイドホルモンの影響を直接受けることになる。ただ、本文中でも述べたように、オスでもエストロゲンを投与すると、それが効いて性行動中枢で性ステロイドホルモン受容体が発現するようになるので、オスの性行動中枢でもごくわずかながら性ステロイドホルモン受容体が発現しているのかもしれない。 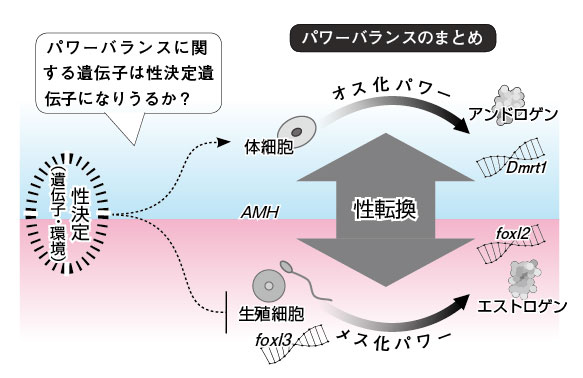
図14.ふたつの性を保障するパワーバランス メダカでは性決定分化時期には体細胞のオス化パワーと生殖細胞のメス化パワーが性を決めることが知られている。どちらのパワーが勝るのか、そのスイッチを入れるのが性決定という過程。やがてこのパワーバランスはステロイドホルモンやdmrt1/foxl2などによるパワーバランスがとってかわり、性を維持する。AMHは初期のパワーバランスに関与。foxl3は、生殖細胞が卵になるか精子になるかを決定する遺伝子。 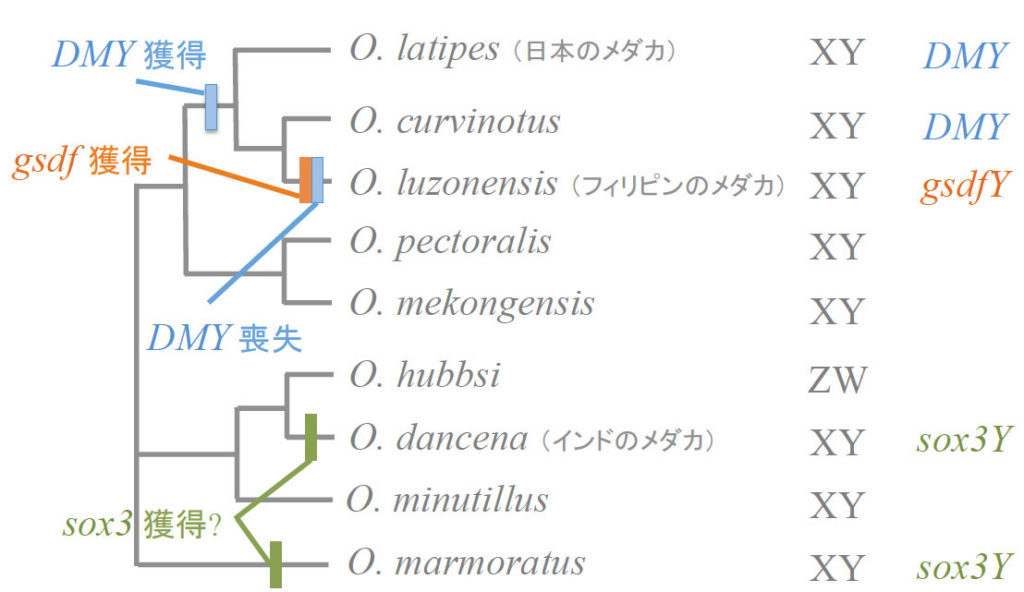
図13.メダカ近縁種で知られるさまざまな性決定遺伝子 近い種でありならがら性決定遺伝子は異なっており、進化の過程で性決定システムが次々に変わっていることがわかる。 文献1より改変 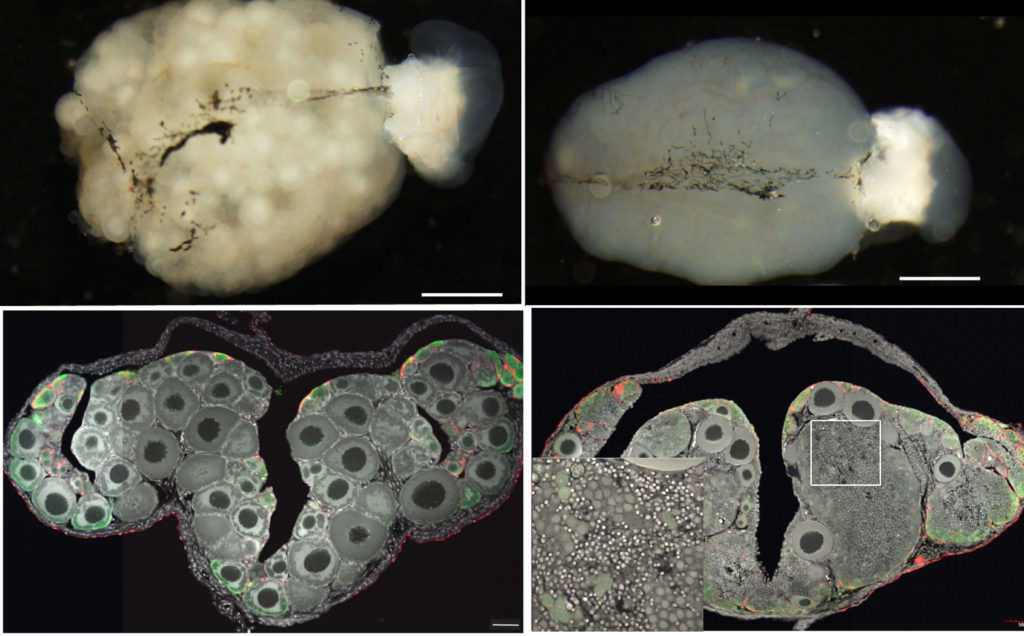
図12.左上:通常のメダカ卵巣の外観 左下:通常のメダカ卵巣の断面。卵巣に特徴的なT字型の卵巣腔と、実質部には丸い卵胞が多数見える。右上:メダカfoxl3変異体の卵巣の外観。右下:メダカfoxl3変異体の卵巣の断面。たくさんの小さな精子が卵巣で作られている。四角枠はその拡大図。 文献14より改変 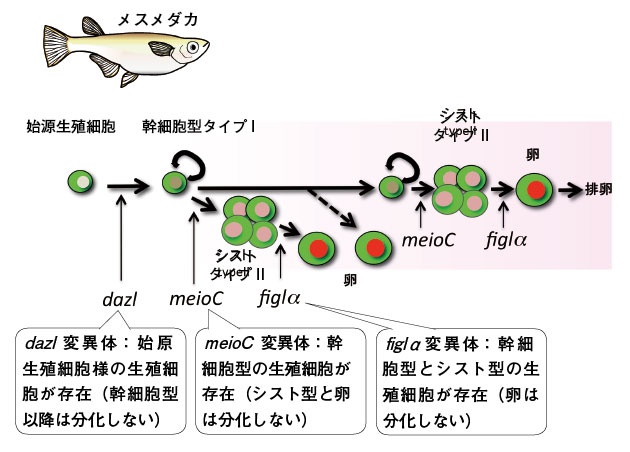
図11.生殖細胞は自身が卵になるか精子になるかにかかわらず、メス化パワーを持つことを示した実験 文献12
第3章:両生類の性
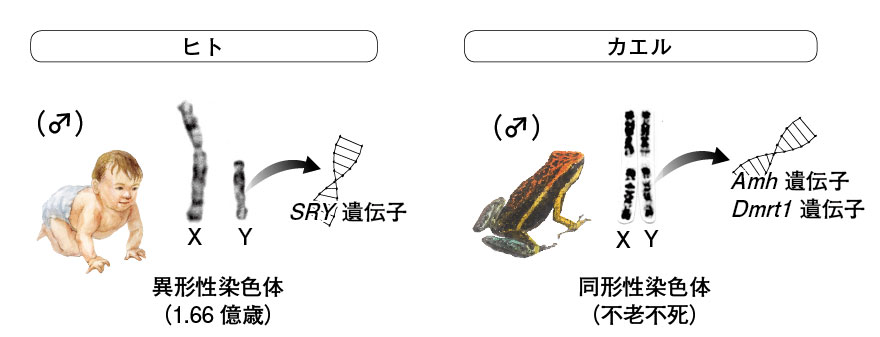
図1. ヒトとカエルの性染色体 ヒトのXとY染色体は形が異なり、これを異形性染色体と呼ぶ。カエルの多くは雌雄同型であり、同形性染色体と呼ぶ。 ヒト性染色体の写真は西田千鶴子氏提供 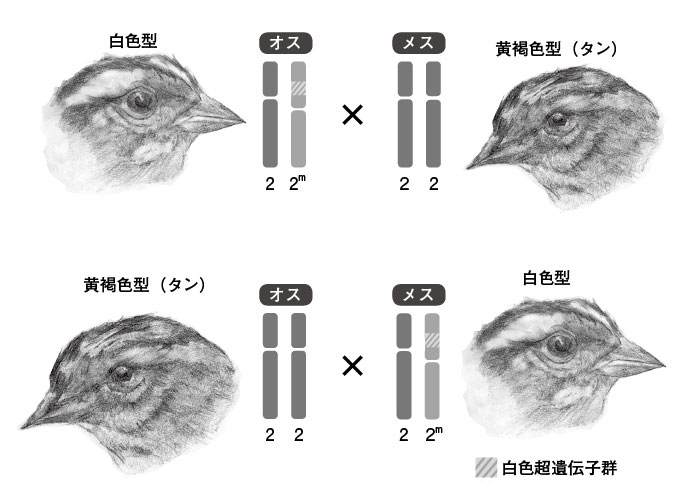
図2.ノドシロトドの色彩を特定する第2染色体と交配の組み合わせ この鳥では羽色を決定する遺伝子が第2染色体上にあり、白色型は常に2/2m、黄褐色型は2/2の組み合わせとなる。交配は常に、オスとメス、そして白色型と黄褐色型の間で行われるため、ふたつの組み合わせがある。 Morph matters: aggression bias in a polymorphic sparrow. Horton BM, Hauber ME, Maney DL – PLoS ONE (2012)よりノトシロトドの図を改変 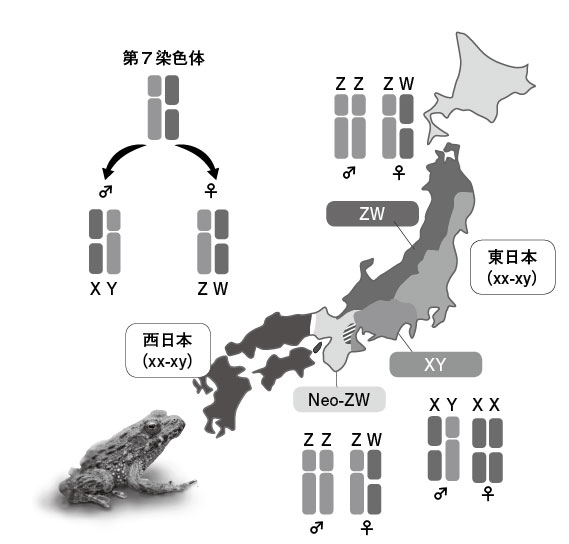
図3.ツチガエルの5つの地域集団 XY、ZWおよびNeo-ZWの3つの集団では第7染色体が性染色体である。XY集団ではオスが異形対、ZWとNeo-ZW集団ではメスが異形対となっている。東日本と西日本の集団は性決定様式はXY型であるが、性染色体は雌雄同じ形で見た目の区別がつかない。 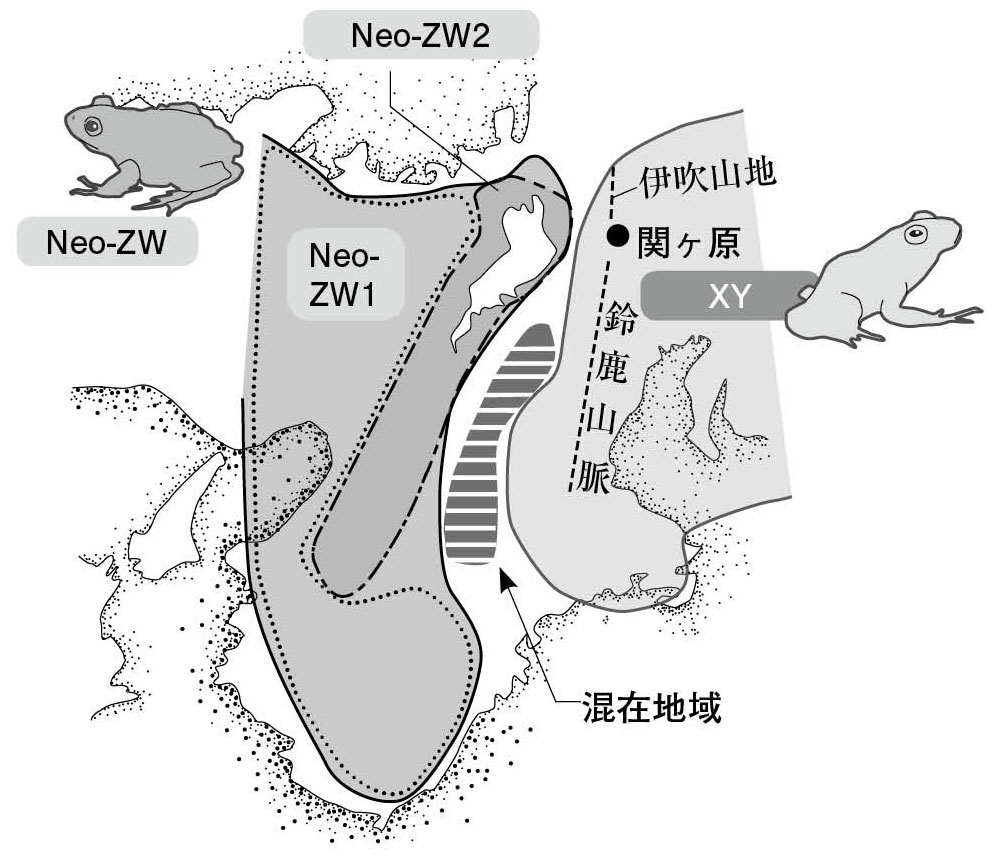
図4.性決定様式がXY型ないしZW型を持つふたつの集団の交雑地帯 近畿地方では、西側にZW型のNeo-ZW集団(濃いグレー)、東側にXY型のXY集団(薄いグレー)が分布する。琵琶湖の東側から鈴鹿山脈西側麓付近までが両者の交雑地帯(縞模様)である。なお、琵琶湖周辺の集団は、ZW型の性決定様式をもつ一方、ミトコンドリア遺伝子はXY集団と等しい。これをNeo-ZW2集団(実線)と呼び、それ以外のNeo-ZW1(点線)と区別する。 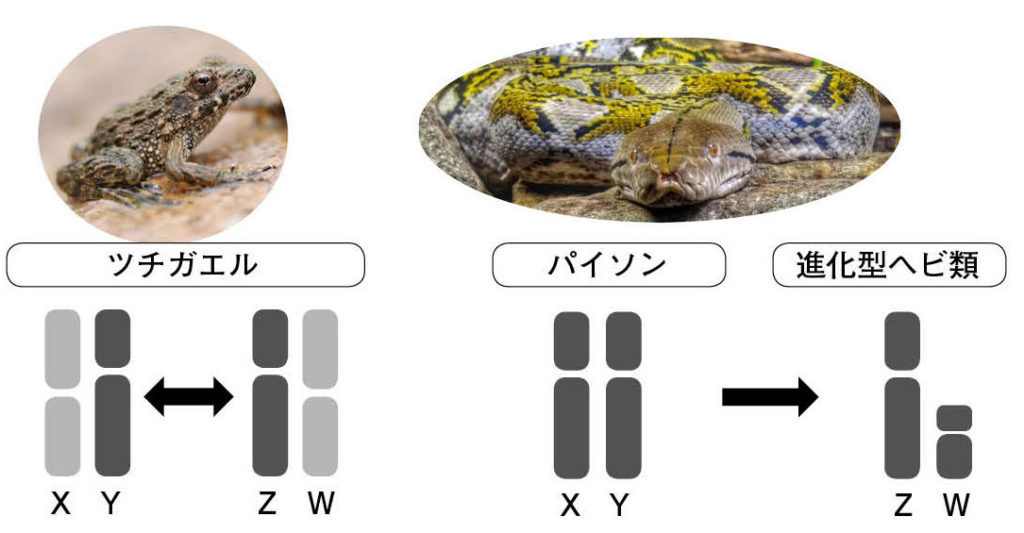
図5.XY型とZW型性決定を担う両刀使いの性染色体 ツチガエルでは、地域集団によって、第7染色体がXY型あるいはZW型の異形性染色体として機能する。一方、ヘビ類では、祖先系統のパイソンがXY型の同形性染色体を持ち、これと相同の染色体が進化系統ではZW型の異形性染色体へと機能転換している。 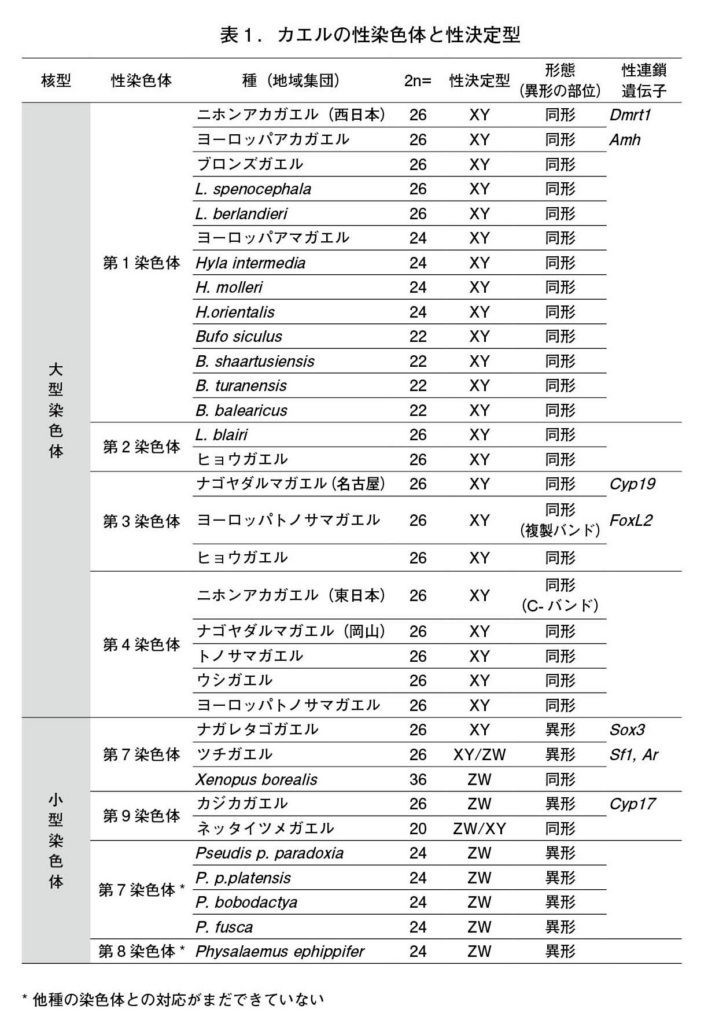
表1.カエルの性染色体と性決定型 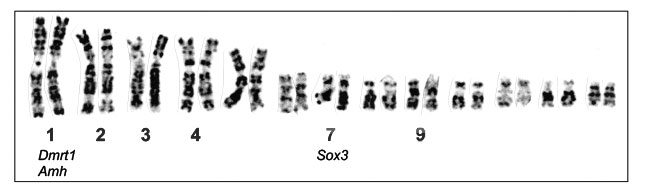
図6.カエル類で使い回される6本の性染色体 表1に示すカエル類の性染色体をツチガエルの核型に対応させた。カエル類では第1、2、3、4、7および9番のいずれかが性染色体になり得る。なお、小型の第7と第9染色体はXY型とZW型性決定の両方の機能を担うことができる。XY型性染色体を濃いグレー、ZW型性染色体を薄いグレーの数字で示す。 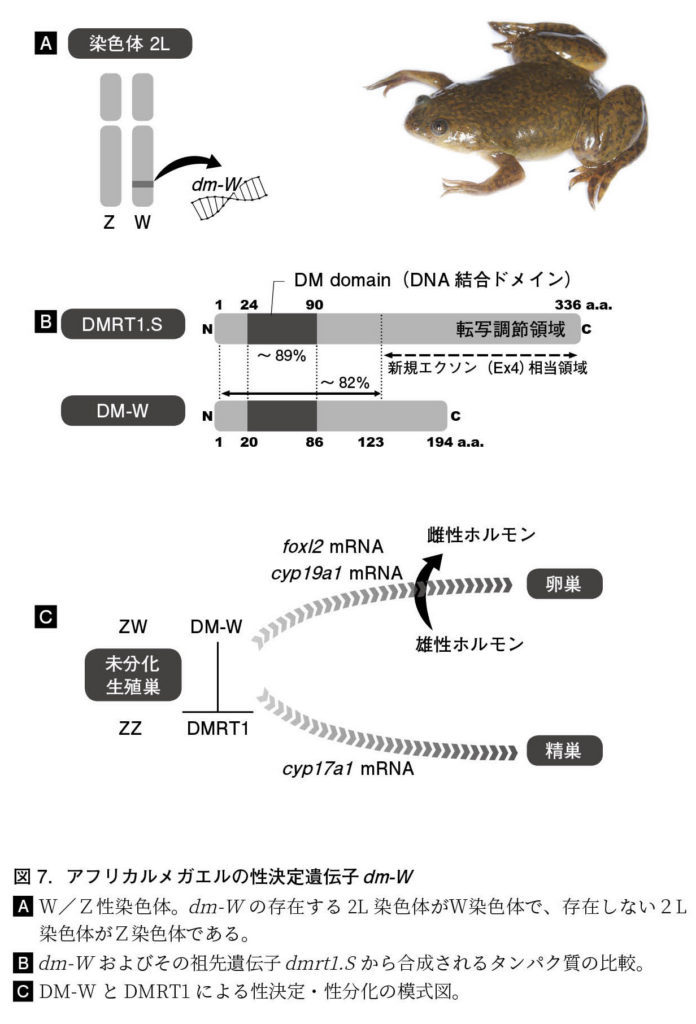
図 7.アフリカルメガエルの性決定遺伝子dm-W (A)W/Z性染色体。dm-Wの存在する2L染色体がW染色体で、存在しない2L染色体がZ染色体である。 (B)dm-Wおよびその祖先遺伝子dmrt1.Sから合成されるタンパク質の比較。 (C)DM-WとDMRT1による性決定・性分化の模式図。 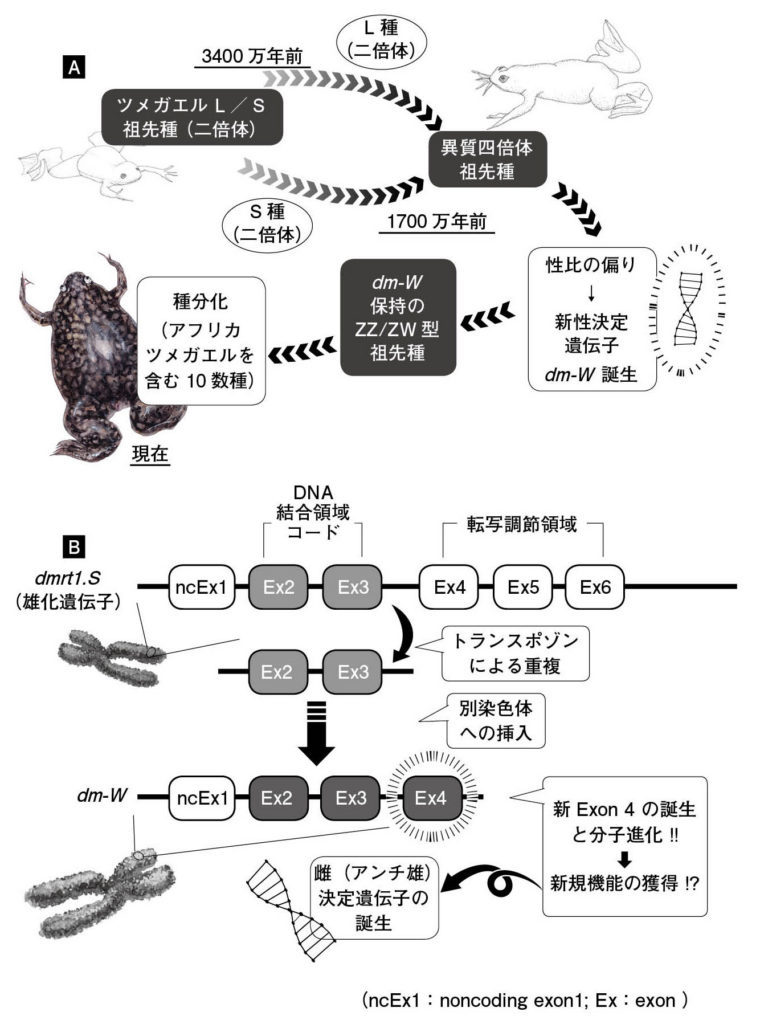
図 8.ツメガエル属における異質四倍体化に伴うdm-Wによる新性決定システムの誕生(仮説) (A)ツメガエル属の近縁二倍体種の異種交配(雑種形成)による異質四倍体化、およびその後のdm-Wを頂点とする新性決定システムの誕生 (B)新機能獲得型の性決定遺伝子dm-Wの誕生。dmrt1.Sの部分重複とシスエレメント・新エクソン創成等によって、アンチ雄決定型の性決定遺伝子dm-Wが誕生した。 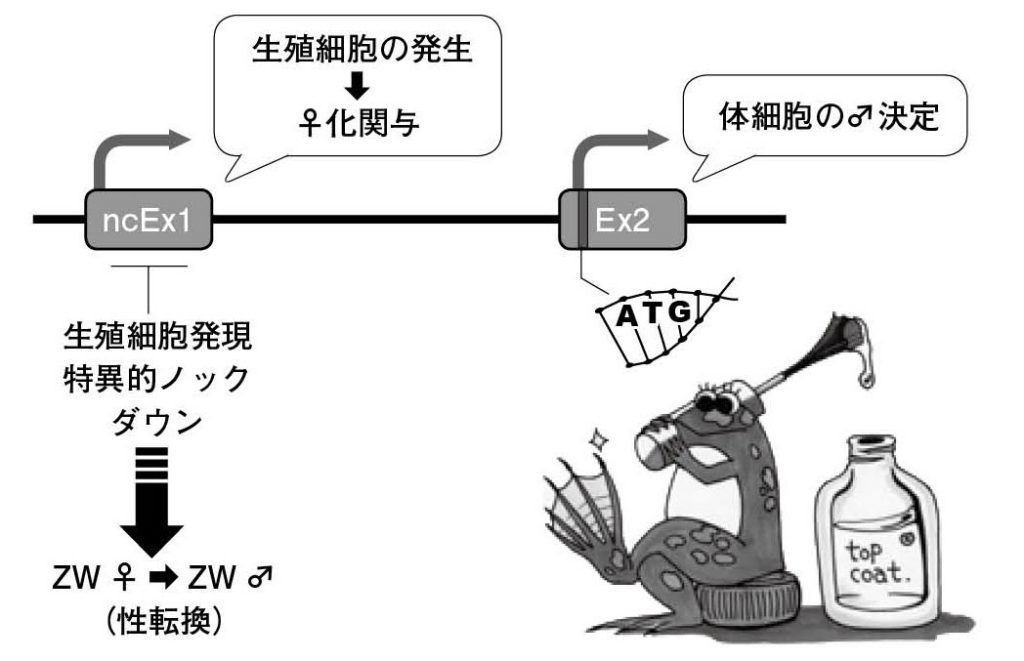
図 9.性の二刀流遺伝子dmrt1 アフリカツメガエルでの実験では、生殖細胞で発現するdmrt1は生殖細胞の発生(♀化に関与)と生殖腺体細胞のオス化の誘導を行う。(ncEx1:noncoding exon 1; Ex2:exon 2; ATG:開始コドンに相当 ) イラスト:菅井玲 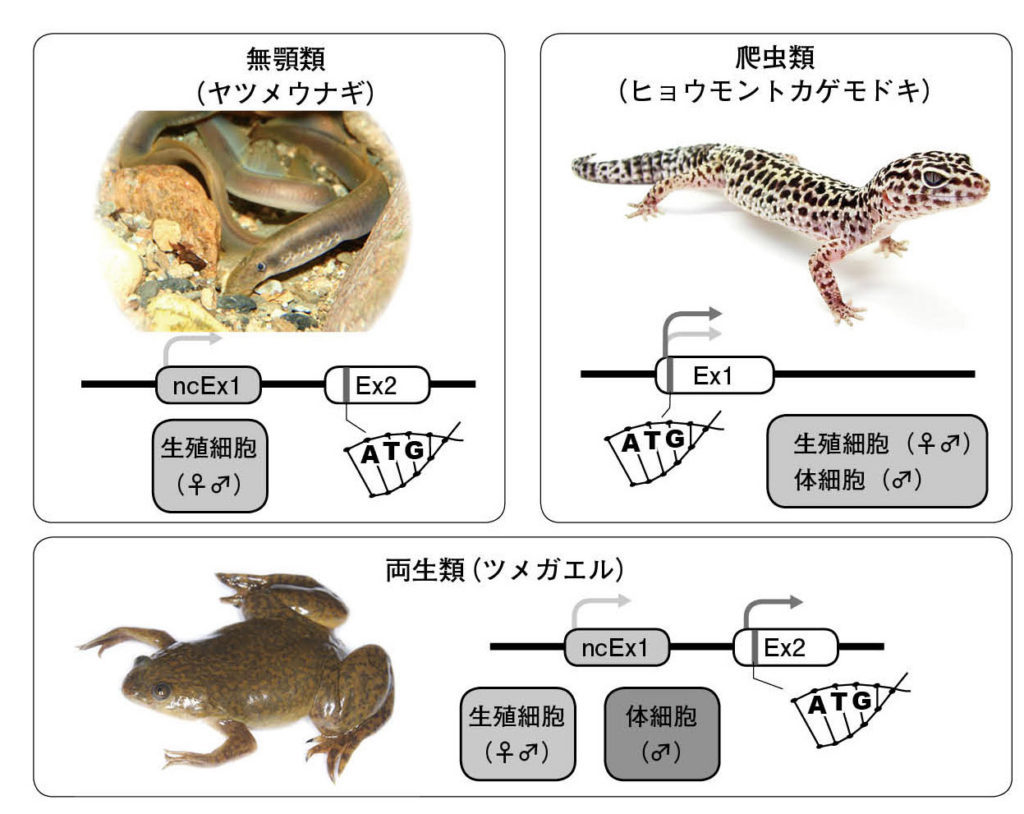
図10.脊椎動物進化におけるdmrt1遺伝子プロモーターのダイナミックな分子進化 dmrt1は脊椎動物の祖先で生殖幹細胞の発生のために誕生し、その後、イントロンが第2のプロモーターとして機能し、体細胞のオス化機能を獲得したと予想される。 ヒョウモントカゲモドキ:photo by Matt Reinbold 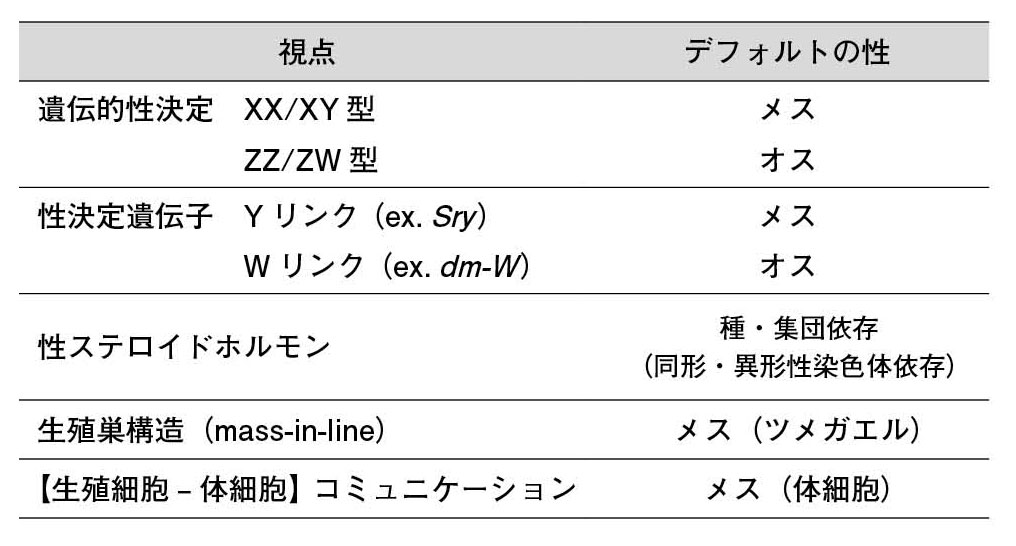
表2.生殖腺のデフォルトの性はメス? オス? 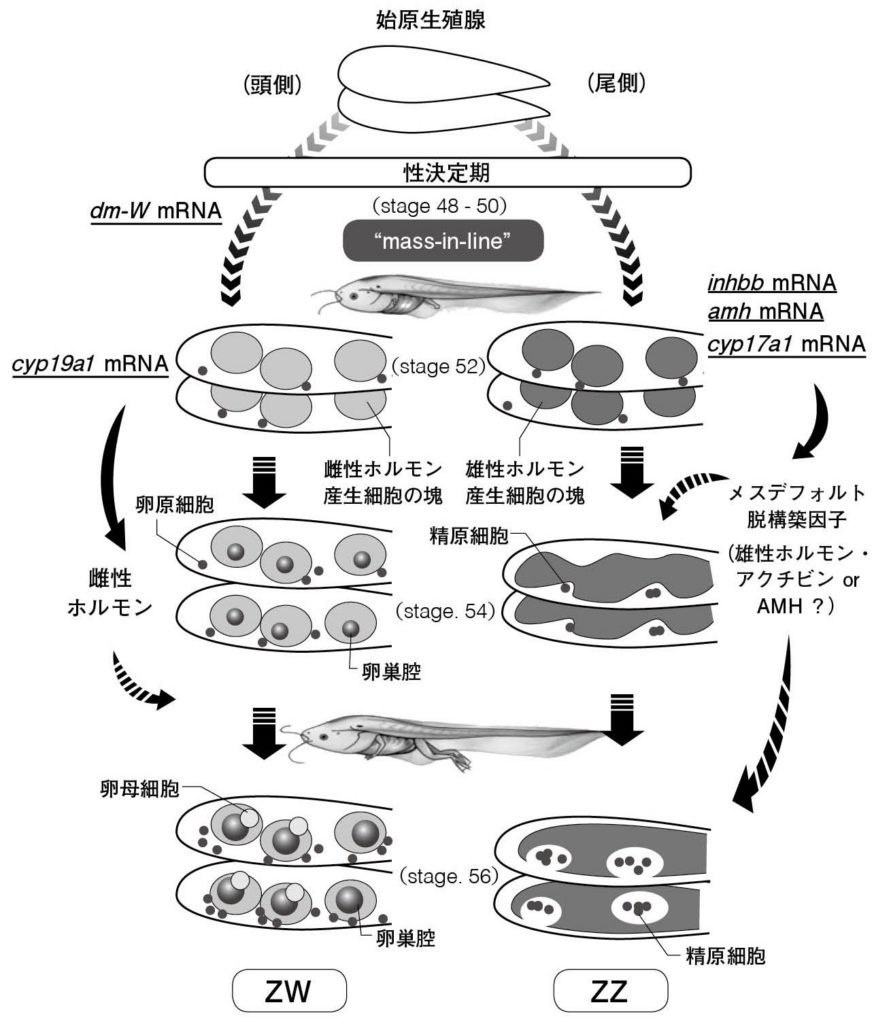
図11. アフリカツメガエル生殖腺におけるメスデフォルト構造 “mass-in-line” 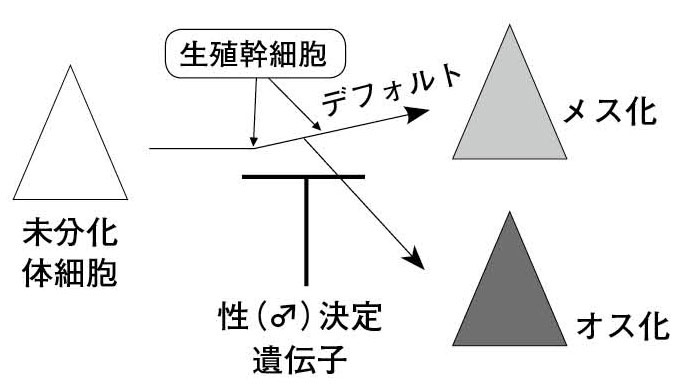
図 12. 生殖細胞による生殖腺体細胞のメスデフォルト(仮説)
第4章:爬虫類の性
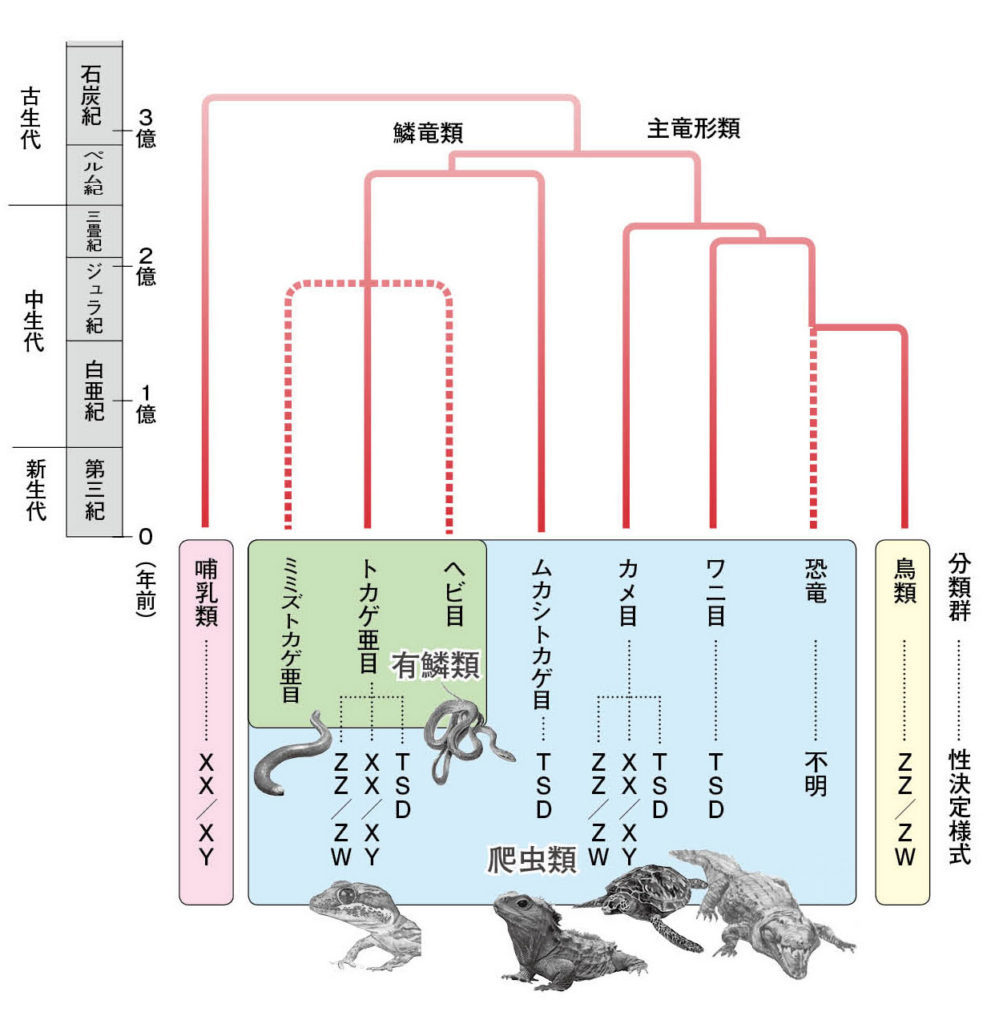
図1.哺乳類、鳥類、爬虫類の系統関係と各分類群の性決定様式。
文献1〜3から引用作成
図2.ニワトリおよび爬虫類3種の核型
ニワトリ核型の写真提供:北海道大学・西田千鶴子氏 ローゼンバーグオオトカゲ:photo by Paul Asman and Jill Lenoble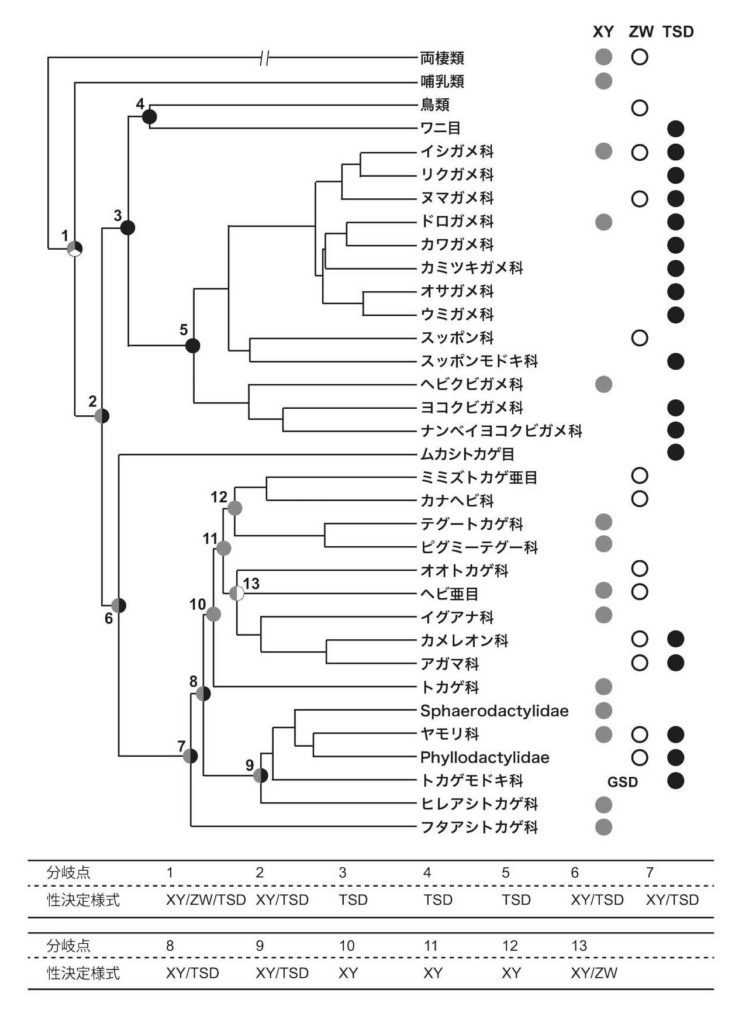
図3. 系統樹に照らし合わせた爬虫類における性決定様式の進化過程
現在までに性決定様式が報告されている種を分類群ごとにまとめ、分類群の系統関係と性決定様式を示した。トカゲ亜目とカメ目については科を最小の分類単位とし、また、鳥類、ワニ目、ムカシトカゲ目、ミミズトカゲ亜目、ヘビ亜目はそれぞれをひとつの分類単位とした。それぞれの分類群の中に一種でもXY型の性染色体、ZW型の性染色体、TSDのいずれかを持つ種が報告されていれば、その分類群の右側にその性決定様式をマークした。
系統樹は文献1〜3にもとづいて作成した。性決定様式のデータは9〜12を参照した。
下表は文献10、13を参照して各分岐点における性決定様式を示した。
図4. Gekko属ヤモリの系統関係と性決定様式
性決定様式の判明している種については括弧内にそれを示した。
文献14を参考に作成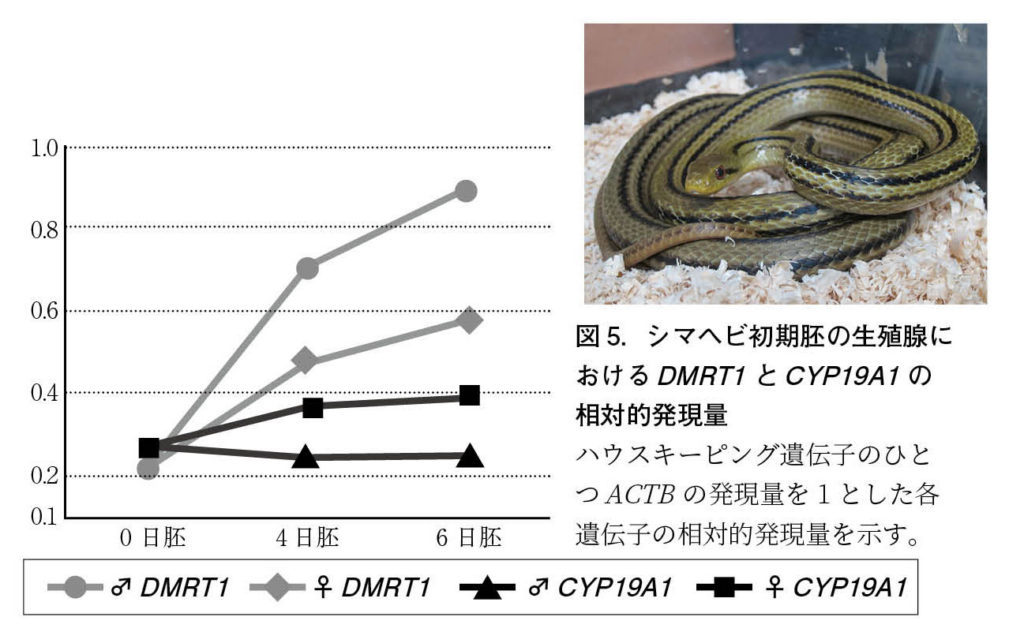
図5.シマヘビ初期胚の生殖腺におけるDMRT1とCYP19A1の相対的発現量 ハウスキーピング遺伝子のひとつACTBの発現量を1とした各遺伝子の相対的発現量を示す。 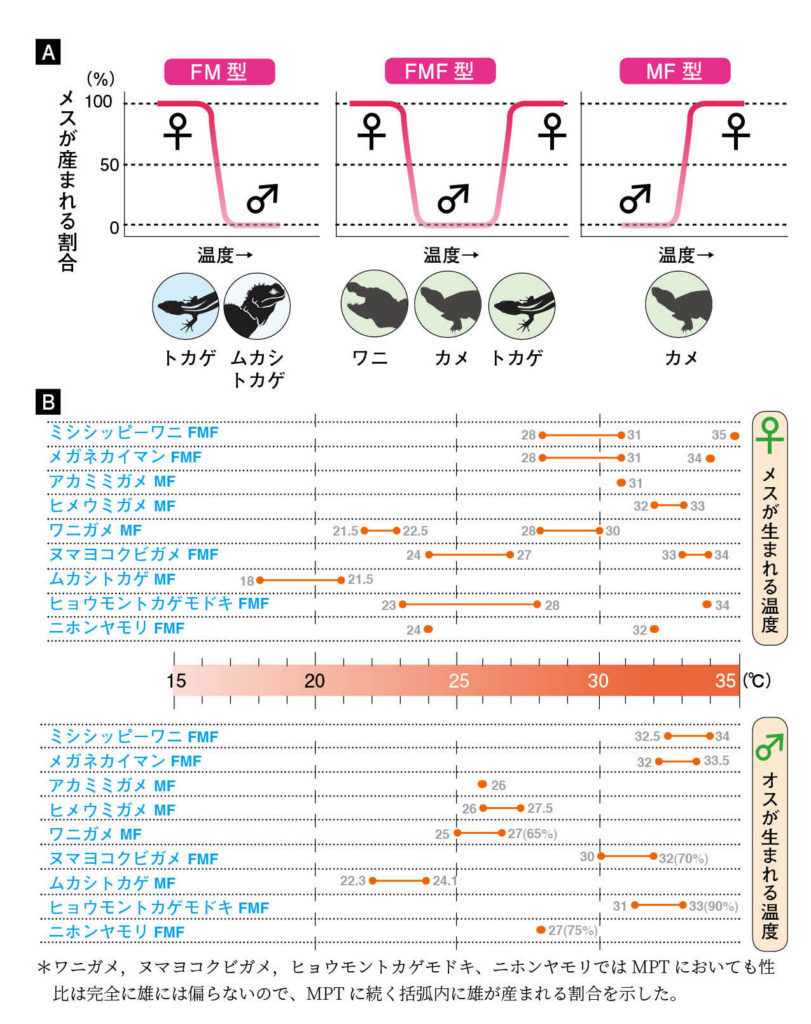
図6.(A)TSDのパターン (B)様々な種における温度と性比の関係 文献23〜27を引用して作成 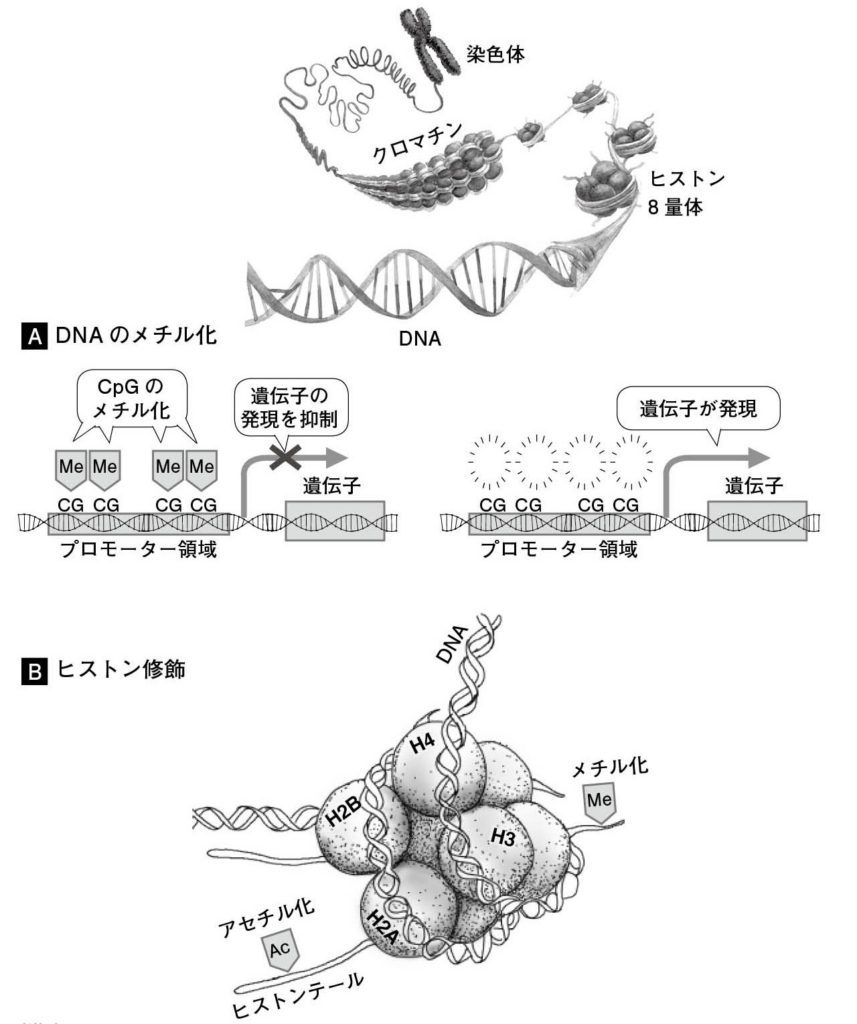
図7. (A)遺伝子プロモーター領域のCpG配列が高頻度にメチル化されると、その遺伝子の発現は抑制され、メチル化が除去されると発現量が高まる。 (B)クロマチンの最小単位であるヌクレオソームはヒストン8量体とDNAから構成され、ヒストンテールがメチル化やアセチル化などの修飾を受けるとクロマチンの状態が変化し、その領域の遺伝子発現が制御される。 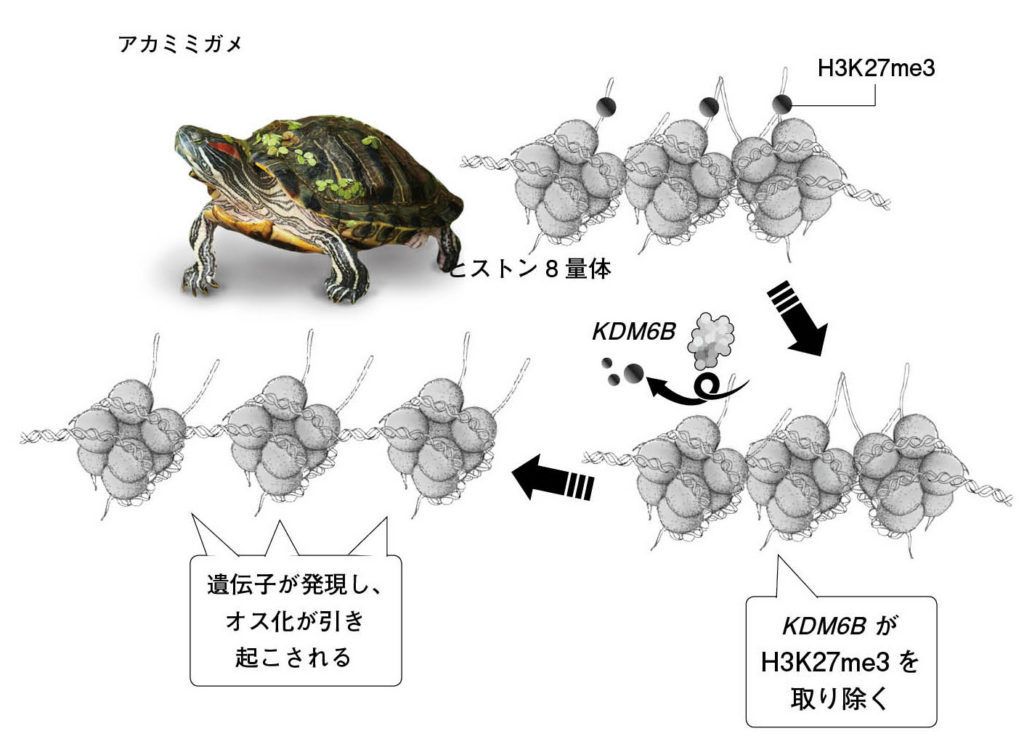
図8.KDM6Bによるヒストンの脱メチル化とDMRT1遺伝子の発現誘導の模式図 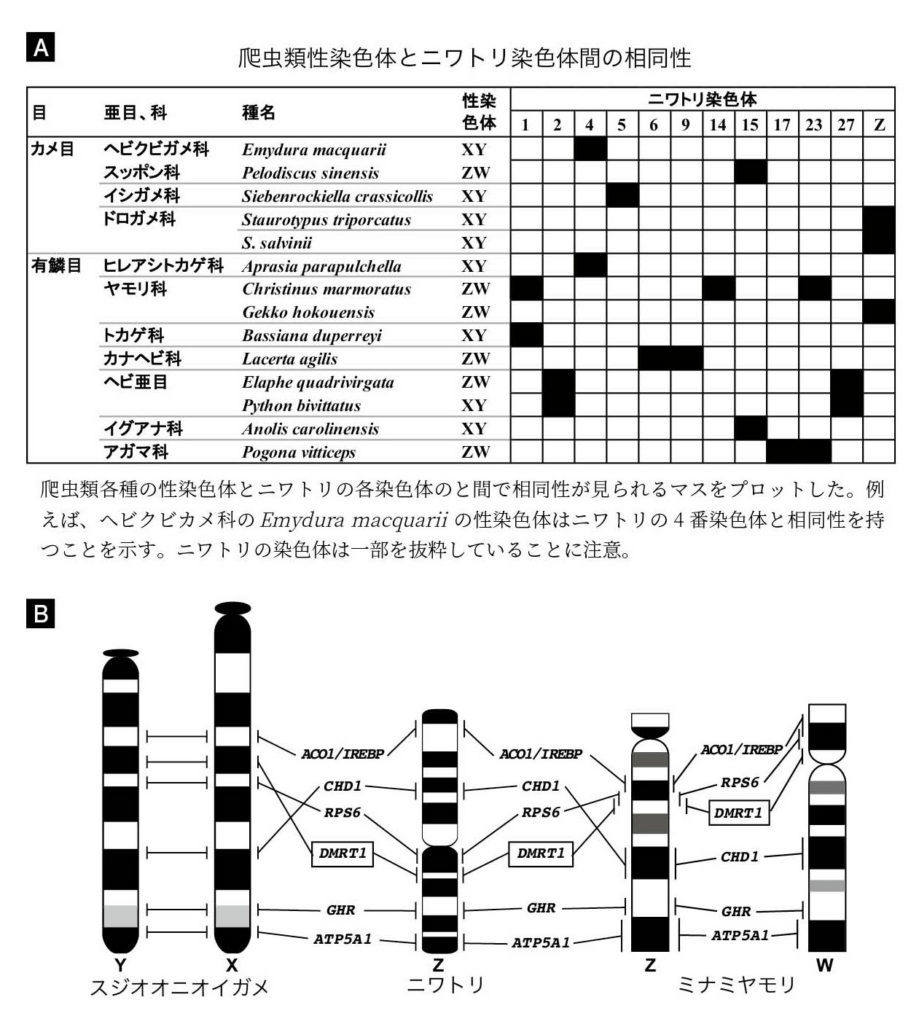
図9. (A)爬虫類14種の性染色体とニワトリ染色体の相同性 (B)ニワトリ、スジオオニオイガメ(Staurotypus triporcatus)、ミナミヤモリ(Gekko hokouensis)の性染色体の比較地図 文献39〜50のデータをもとに作成 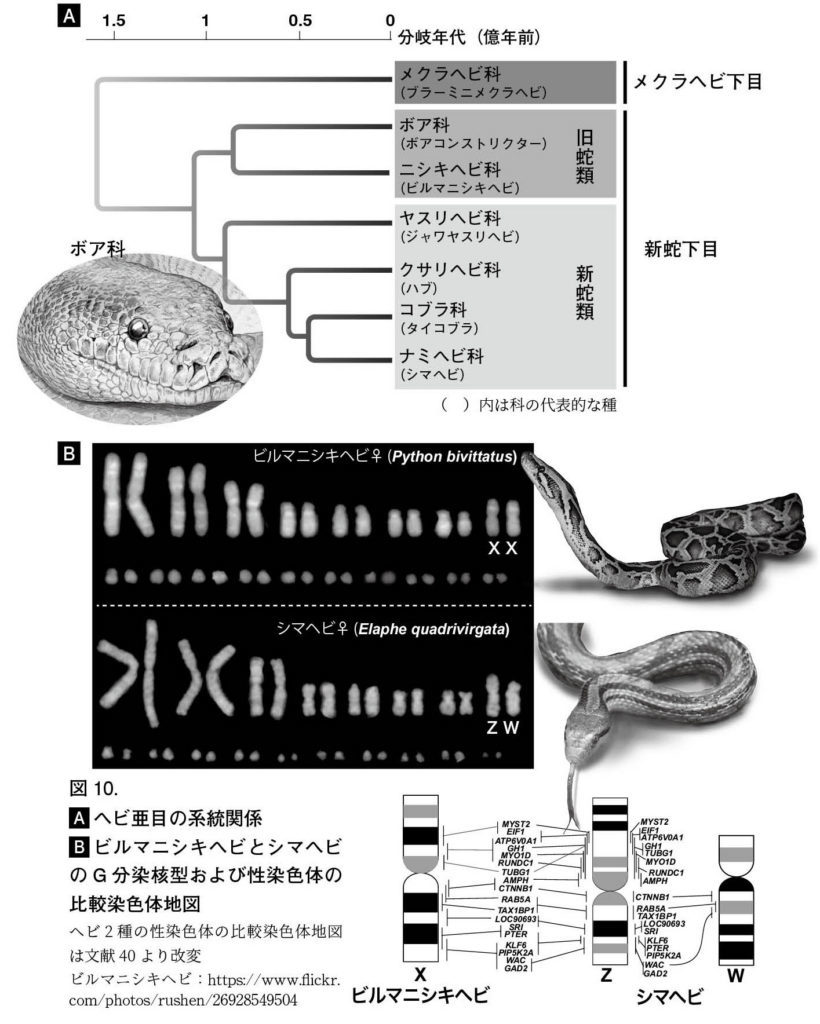
図10. (A)ヘビ亜目の系統関係 (B)ビルマニシキヘビとシマヘビのG分染核型および性染色体の比較染色体地図 ヘビ2種の性染色体の比較染色体地図は文献40より改変 ビルマニシキヘビ:https://www.flickr.com/photos/rushen/26928549504 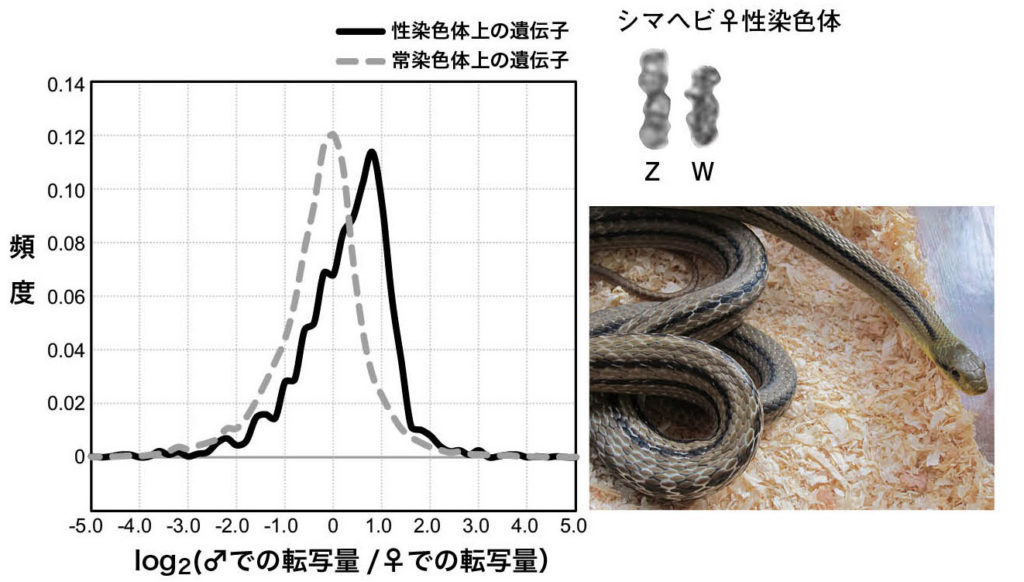
図11.シマヘビにおける性染色体上と常染色体上の遺伝子の発現量の雌雄差 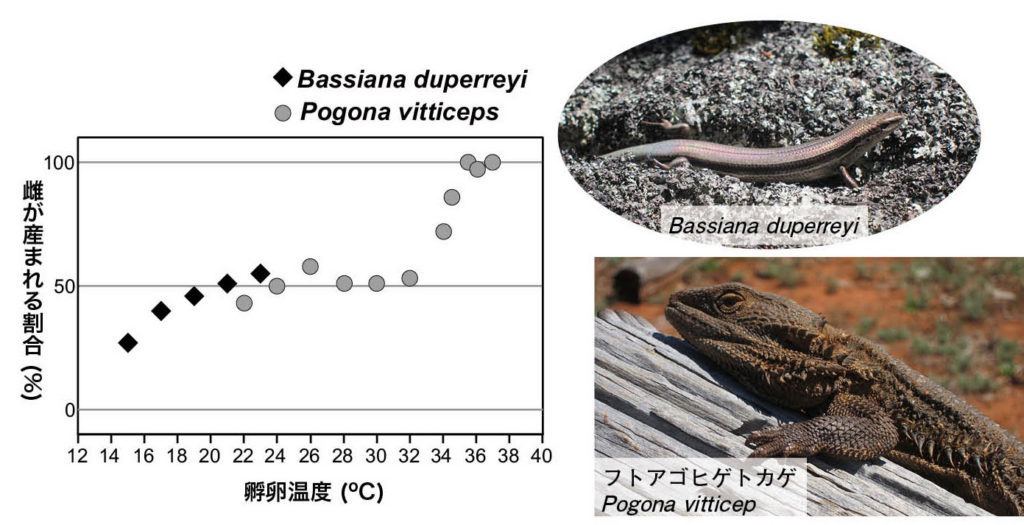
図12.GSDを持つ種における温度と性比の関係 文献59、60をもとに作成。 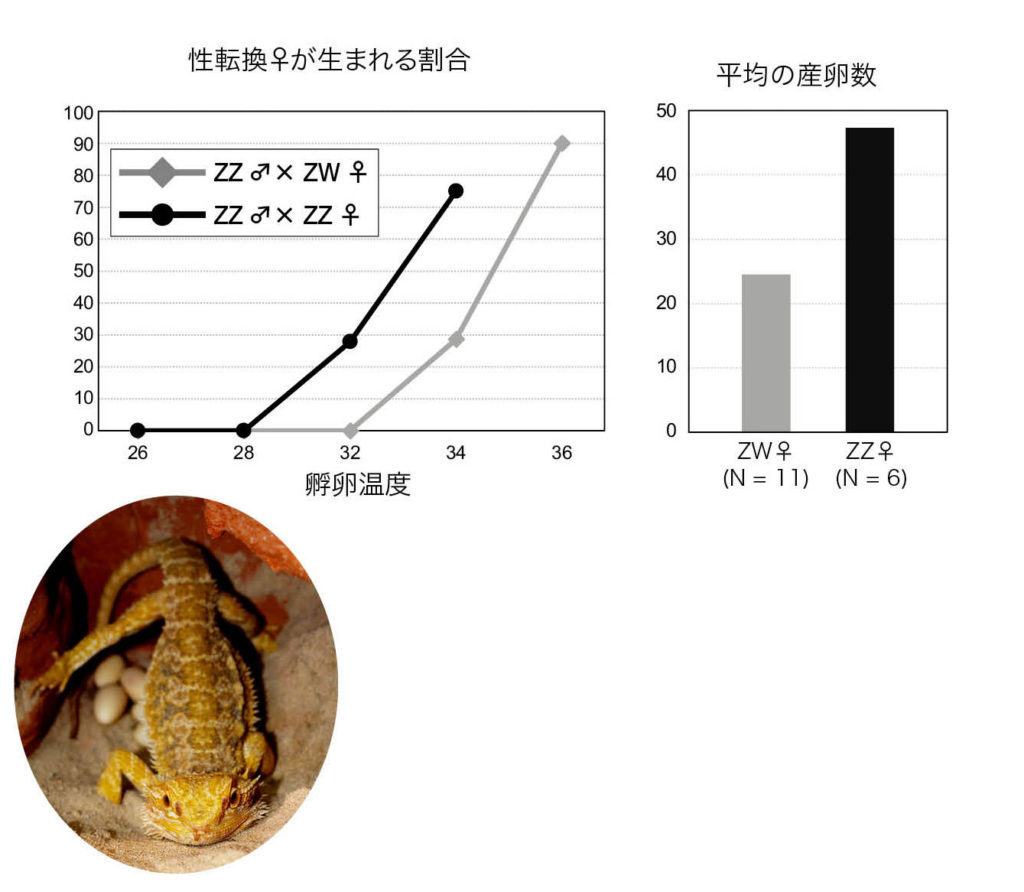
図13. フトアゴヒゲトカゲにおける性転換雌が生まれる割合と平均産卵数 野生型同士の交配(ZZ♂×ZW♀)比べて、野生型雄と性転換雌の交配(ZZ♂×ZZ♀)から生まれる子供は温度に誘導される性転換に対して感受性が高い(左)。また、性転換雌は野生型雌よりも多くの卵を1シーズンに産む(右)。 文献62から引用して作成 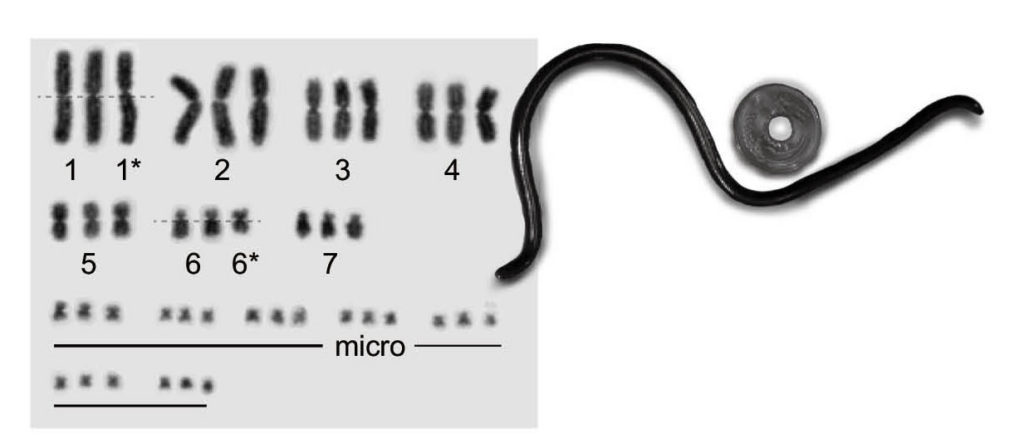
図14.ヘビ亜目で唯一の単為生殖種であるブラーミニメクラヘビとその核型 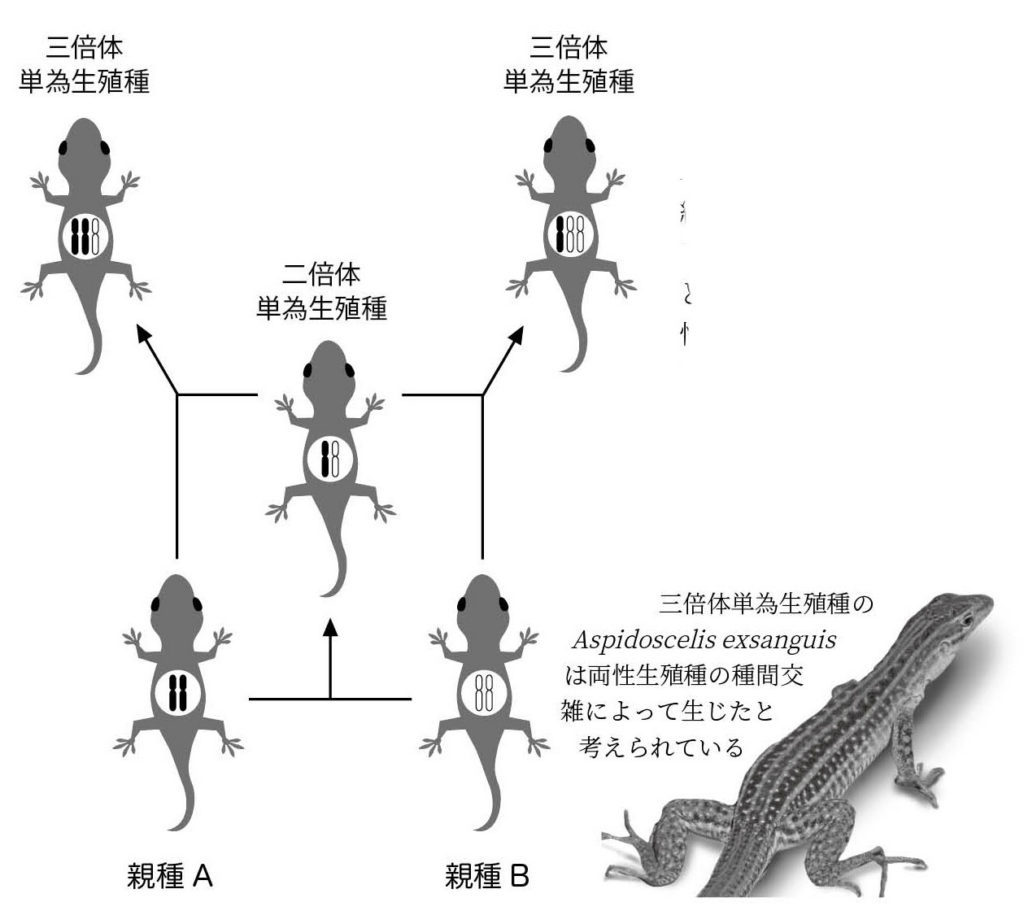
図15. 二倍体と三倍体の単為生殖種が形成される過程 二倍体の単為生殖種は近縁種間の交雑によって生じ、その種間雑種が親種と交雑することで三倍体性の単為生殖種が生じたと推測される。二倍体の単為生殖種は単為生殖能力を獲得した後も受精能力を維持していたと考えられる。 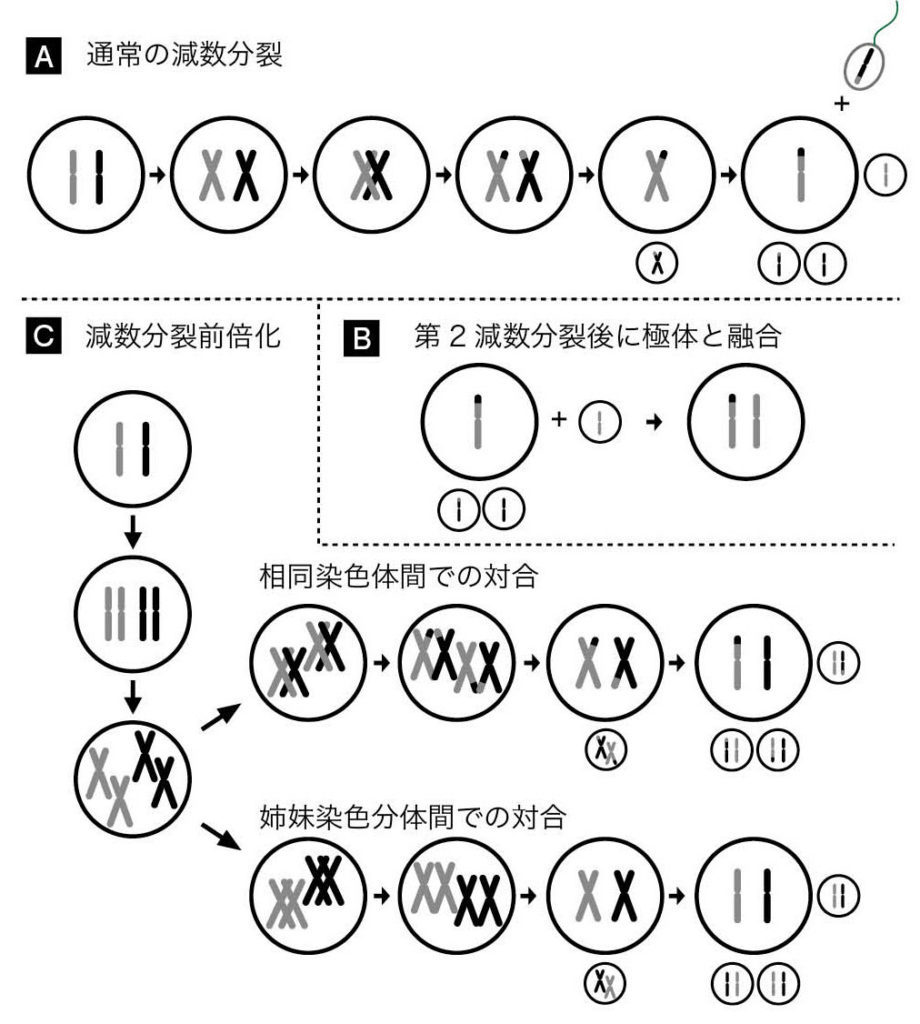
図16.(A)有性生殖種の卵形成における減数分裂 (B)条件的単為生殖における卵形成 (C)単為生殖種の卵形成における減数分裂
第5章:鳥の性
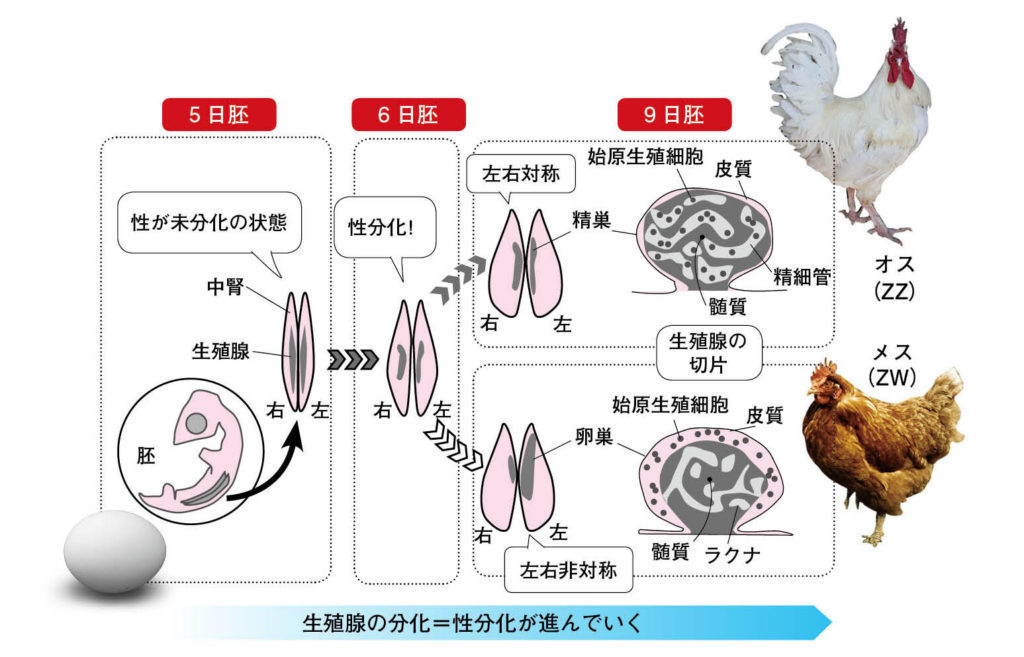
図1.ニワトリ生殖腺の性分化 ニワトリの生殖腺は中腎の腹側に形成され、6日胚頃のZZ胚には精巣が、ZW胚には卵巣が分化する。オスの精巣は左右対称に発生し、メスの卵巣は右側が退行し左右非対称に発達する。9日胚では、雄の精巣の皮質は薄く髄質が厚い。髄質部分には精細管構造が見られ、その中に始原生殖細胞が局在する。メスでは皮質が厚く、皮質部分に始原生殖細胞が局在する。メスの髄質部分には多数のラクナ(小窩とよばれる空隙構造が見られる。 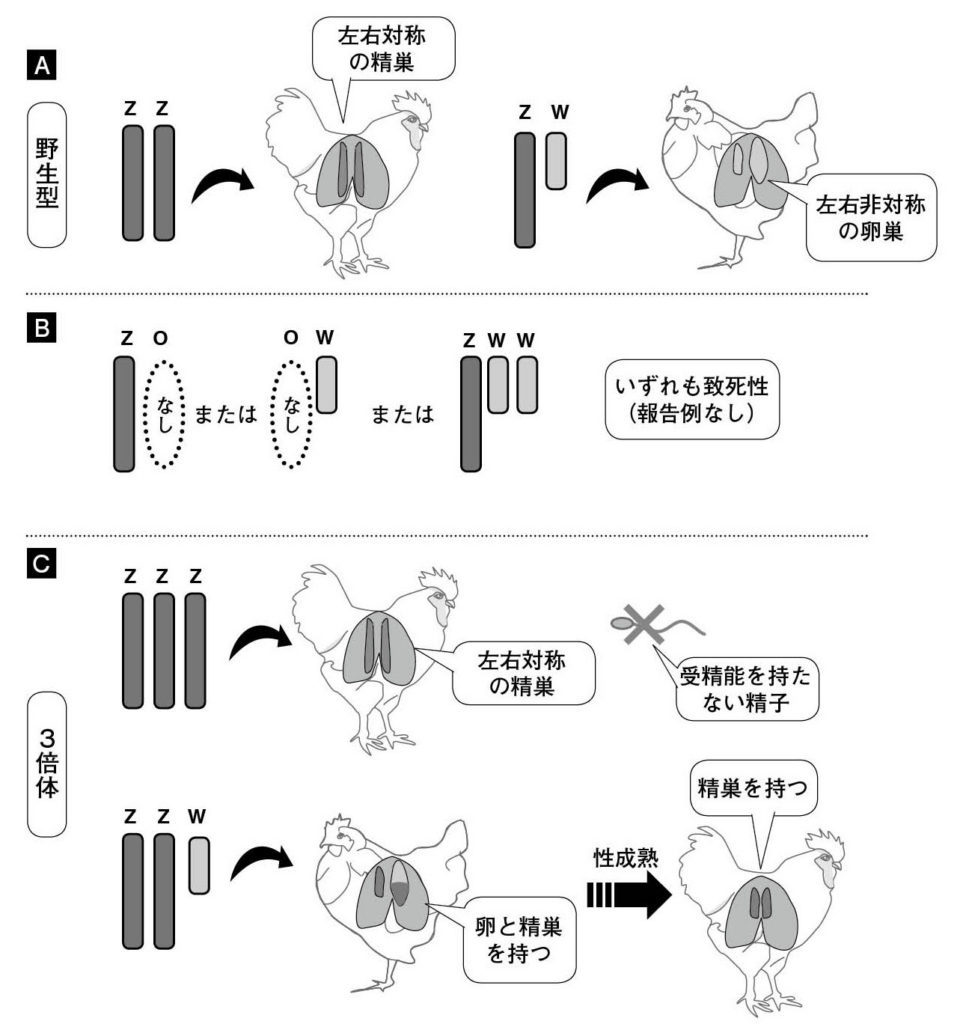
図3.ニワトリの異数体研究が示すニワトリの性決定における性染色体の役割 (A)通常のニワトリでは、オスがZ染色体を2本持ち、両側の精巣を発達させる。雌はZ染色体とW染色体を1本ずつ持ち、左右非対称に左側の卵巣を発達させる。 (B)二倍体の常染色体と1本のZ染色体を持つZO個体、二倍体の常染色体と1本のW染色体を持つOW個体、二倍体の常染色体と2本のZ染色体と1本のW染色体を持つ個体に関する報告はほとんど無いため、致死性と考えられる。 (C)三倍体のZZZ個体は、オスの様に両側の精巣を発達するが、精子は異常となる。ZZW個体は発達初期ではメス型で卵精巣を形成するが、卵巣組織は退化して、性成熟後はオスの特徴を示す。 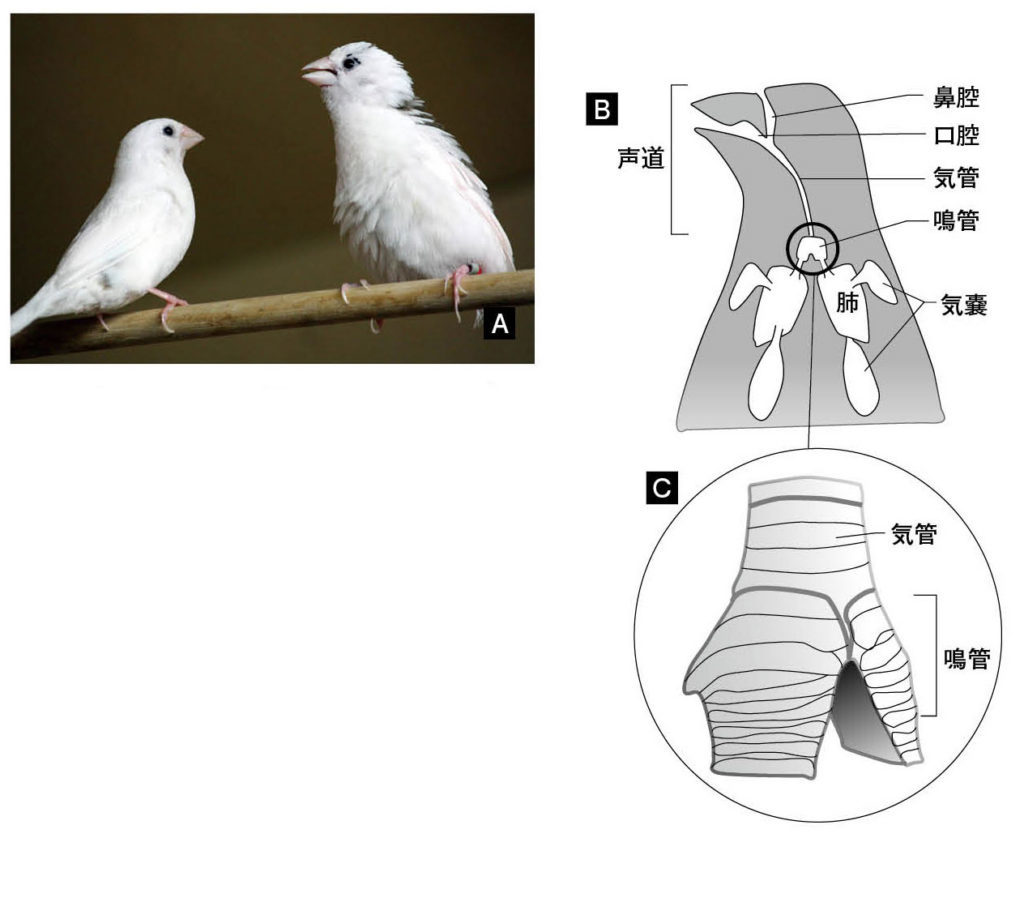
図4.ジュウシマツと鳥の発声器(鳴管) (A)求愛歌をうたうジュウシマツ 写真:日本医療科学大学・鈴木研太博士提供 (B)鳥の発声では、エネルギー源は肺や気嚢からの呼気、音源は左右の気管支の付け根にある鳴管、音源から気管を伝わって嘴からでてくるまでに強調される周波数帯と減衰される周波数帯があり(フィルター)、最終的な発声の特徴が決まる。 (C)気管が2つの気管支に分岐する部分が発達してできた鳴管。焼き鳥ではさえずりと呼ばれる部位。 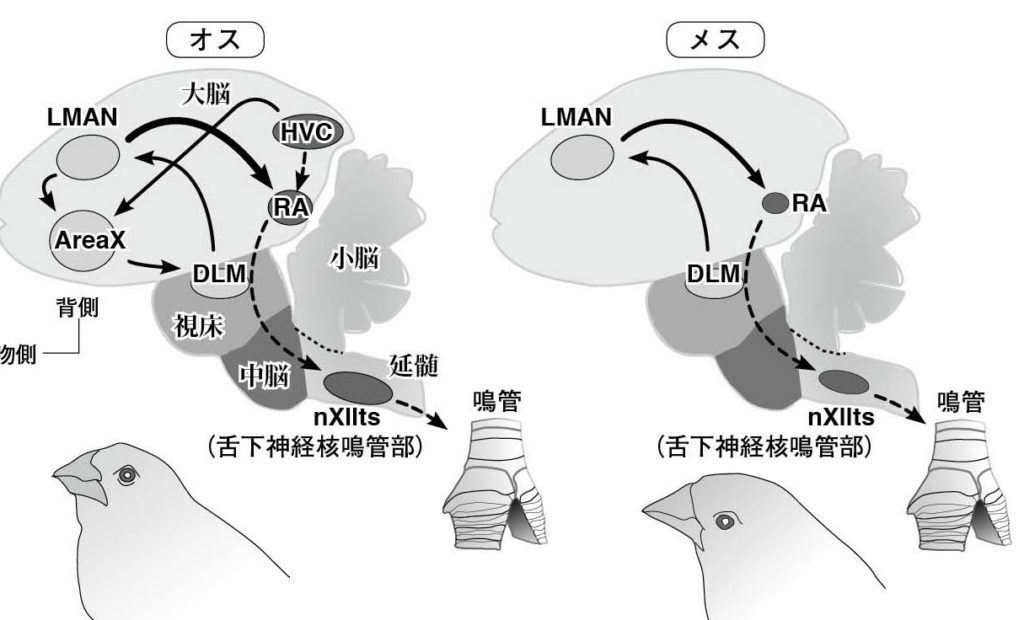
図5.鳴禽類の歌制御系と雌雄差 鳴禽類の脳を矢状断面状に図示した。迂回投射系を実線、直接投射系を破線で示している。 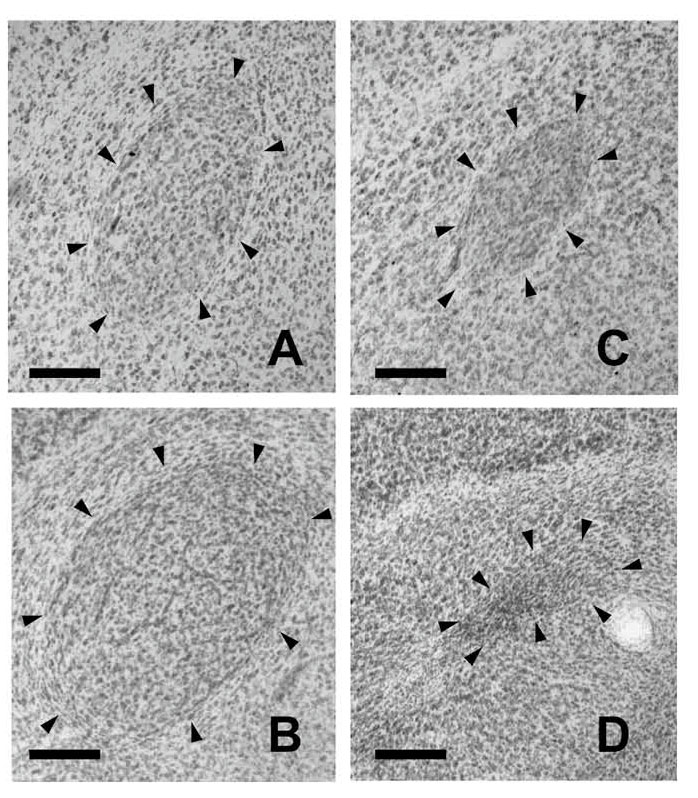
図6.ジュウシマツのRAの雌雄差 矢頭で囲まれた領域がRA。オスでは大きくなるのに対しメスでは痕跡的になる。 A:孵化後35日の雄 B:成鳥の雄 C:孵化後35日の雌 D:成鳥の雌 スケールバーは200 μm 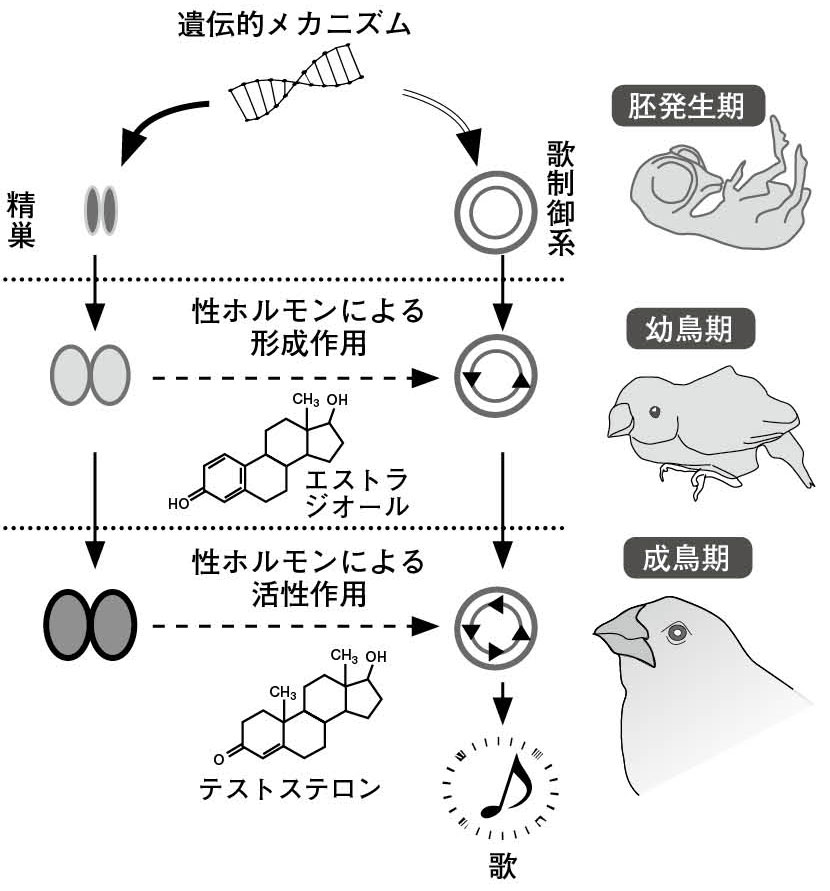
図7.鳴禽類の歌制御系の形成と歌行動の活性のシナリオ オスのみが歌をうたう小鳥の歌制御系の形成には、孵化後45日までの幼鳥のときに脳のエストラジオールへの暴露が必要で、成鳥になったときの歌の活性にはテストステロンへの暴露が必要である。破線は古典的な性ホルモンの作用を示し、二重線は近年支持される、歌制御系を構成する細胞の自律的(遺伝的)な性決定を表している。 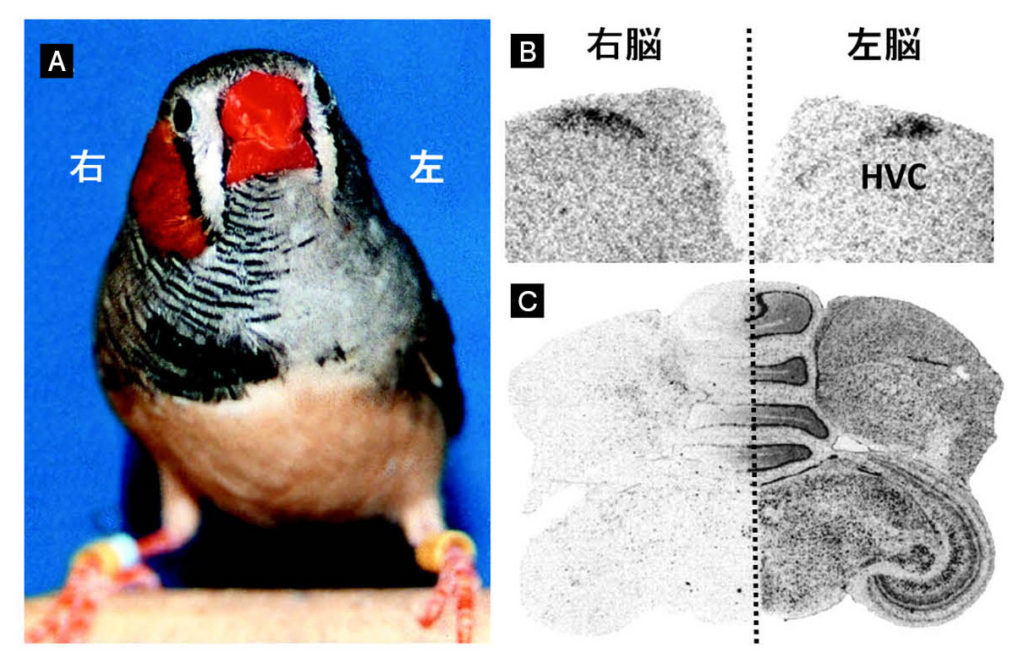
図8.キンカチョウギナンドロモルフとその脳の左右差 (A)キンカチョウギナンドロモルフは右側がオス特有の羽装(赤橙色の頬、胸の縞模様とその下の黒帯)を示し、左側はメス特有の灰色の羽装をしている。 (B)正常個体ではHVCの大きさに左右差はない。オスのHVCはメスに比べて非常に大きい。メスのHVCは痕跡程度になっている。キンカチョウギナンドロモルフの右脳のHVCは左脳のHVCに比べて大きい。 (C)メスだけがもつW染色体に存在するAsw遺伝子は脳の左側で強く発現している。 文献10より。Copyright (2003) National Academy of Science, U.S.A. 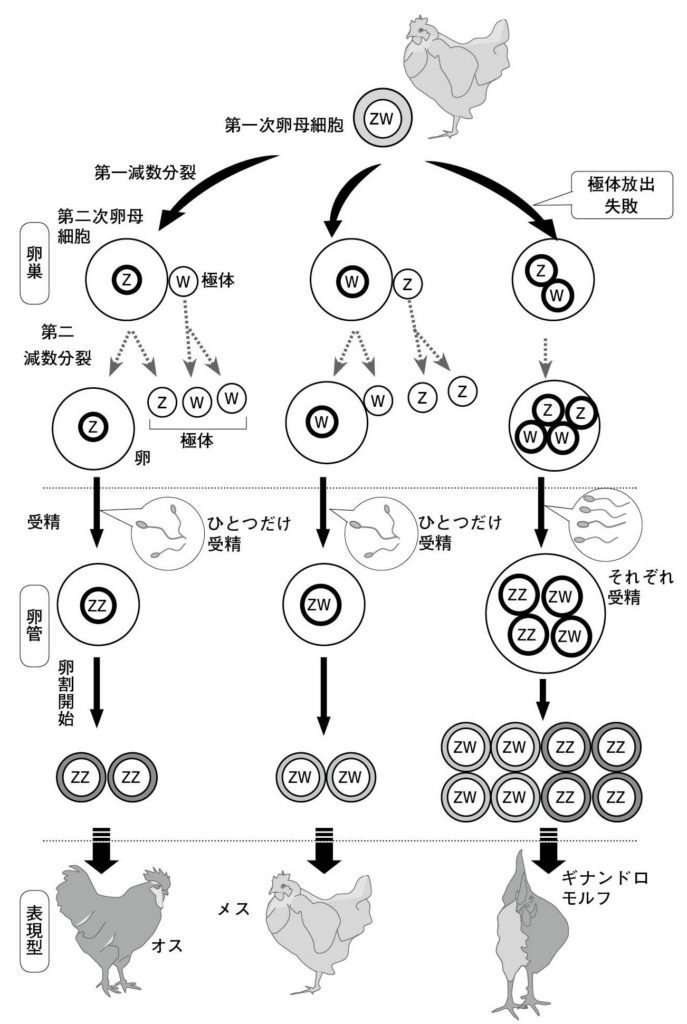
図9.ギナンドロモルフの発生機序(仮説) 鳥類は多精受精のため卵内に精子が多数侵入する。この仮説では、減数分裂の際に極体が放出されずに、雌性前核と3つの極体がそれぞれ別の精子由来の雄性前核と接合核を形成するというものである。ひとつの卵のなかでZWとZZの接合核がそれぞれ雌と雄の組織・器官を同時に形成してギナンドロモルフ(性モザイク)が発生すると考えられている。 
図10.ウズラ ウズラは、手のひらの上にのるくらいの大きさのキジ目に属する渡り鳥である。八宝菜の上にのっている小さな卵を産む鳥。産業動物でありながら実験動物としても活躍している。ジュウシマツと同様に日本で家畜化された動物。 写真:麻布大学・原田倫圭 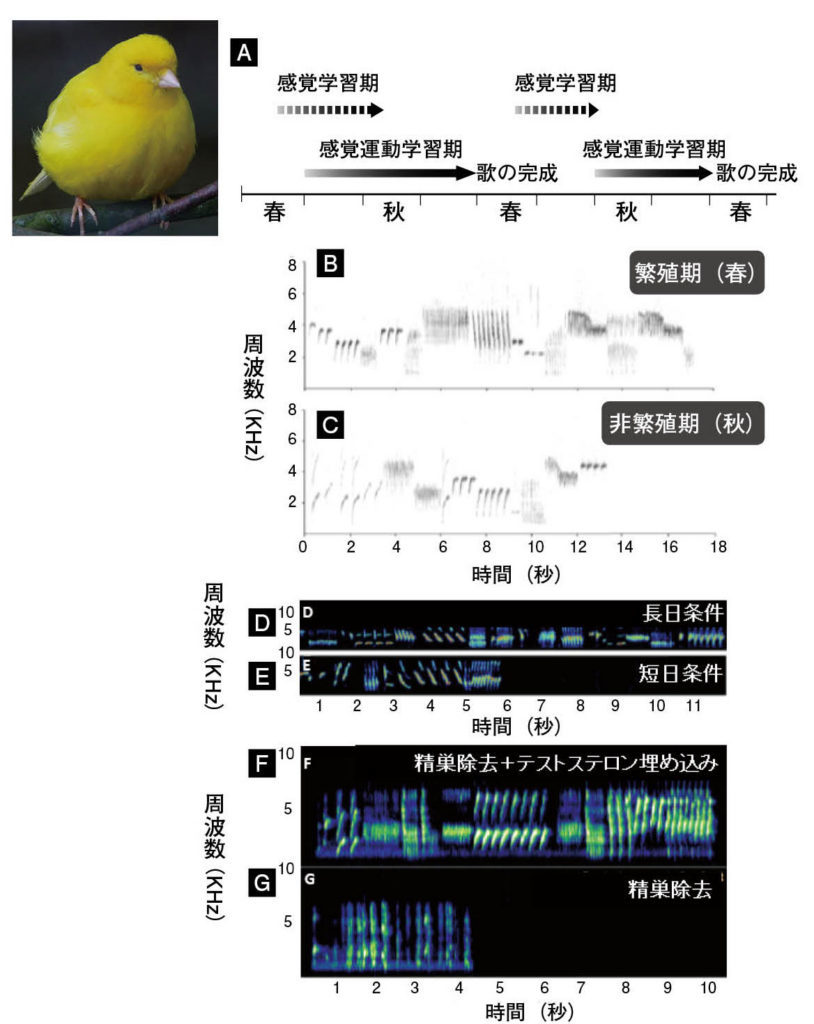
図11.カナリアの歌学習と日長とテストステロンによる歌行動の制御 (A)毎年新しい歌を覚えるカナリアの歌学習スケジュール。(B)(C)カナリアは非繁殖期に比べて繁殖期に長い歌をうたう。(D)(E)長日条件下で飼育したカナリアは短日条件下で飼育するカナリアよりも長い歌を歌う。(F)(E)精巣除去した個体に比べて、精巣除去した上でテストステロンを埋め込んだカナリアは長い歌をうたう。精巣除去は精巣から分泌されるテストステロンをなくすために行われる。 文献13より許可を得て改変 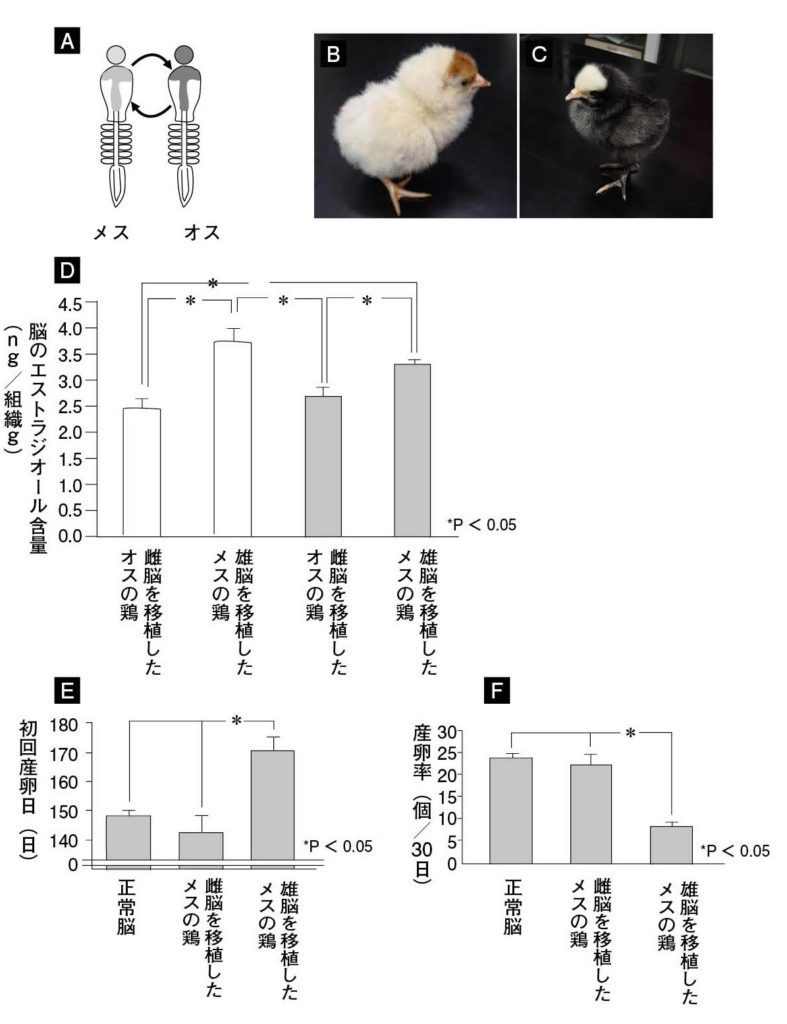
図12.ニワトリ脳キメラの作製 将来脳になりうる部分を胚の時期に雌雄で入れ替えた。雌雄で脳を交換移植し孵化した例、脳と体の性が異なるニワトリキメラ(写真は国立環境研究所 前川文彦博士提供)。ニワトリキメラの脳内エストラジオール含有量、初回産卵日、産卵率。 文献15より許可を得て改変 
図14.セーシェルヨシキリ 
図15.アオガラ
第6章:哺乳類の生殖腺の性
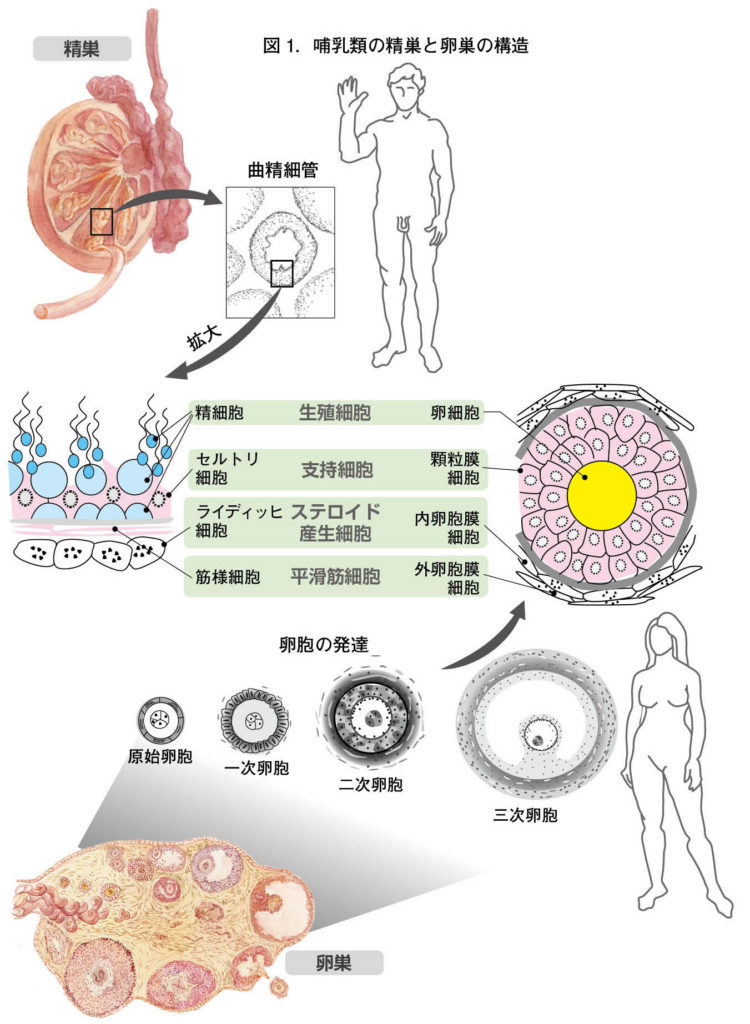
図1.哺乳類の精巣と卵巣の構造 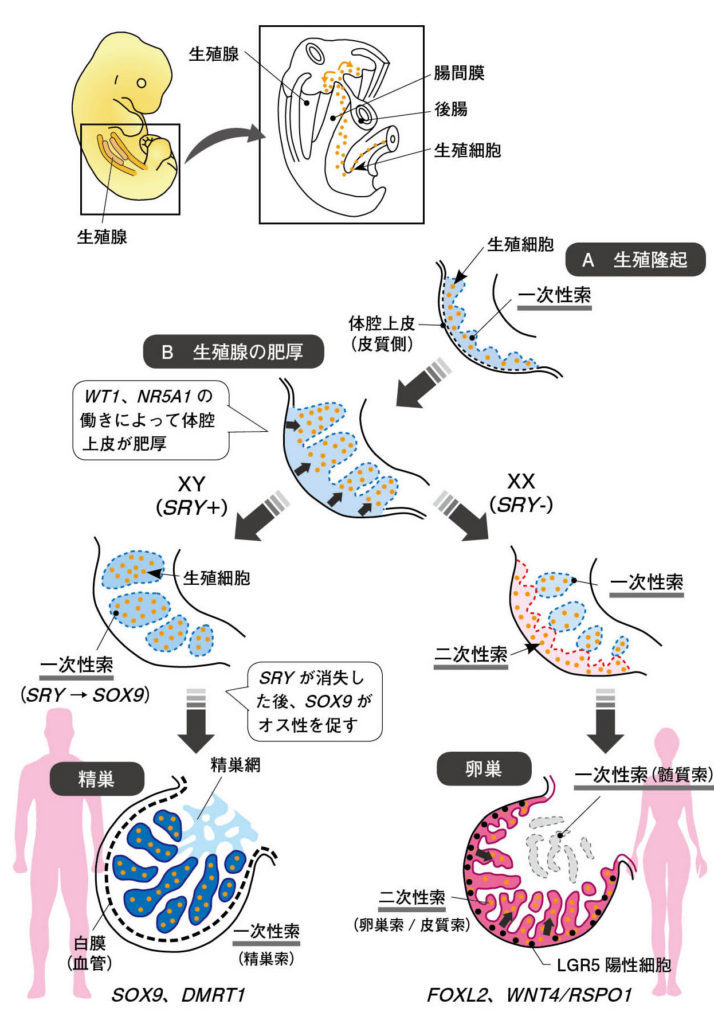
図2. 生殖隆起と一次性索(髄質)と二次性索(皮質)の形成の概略図 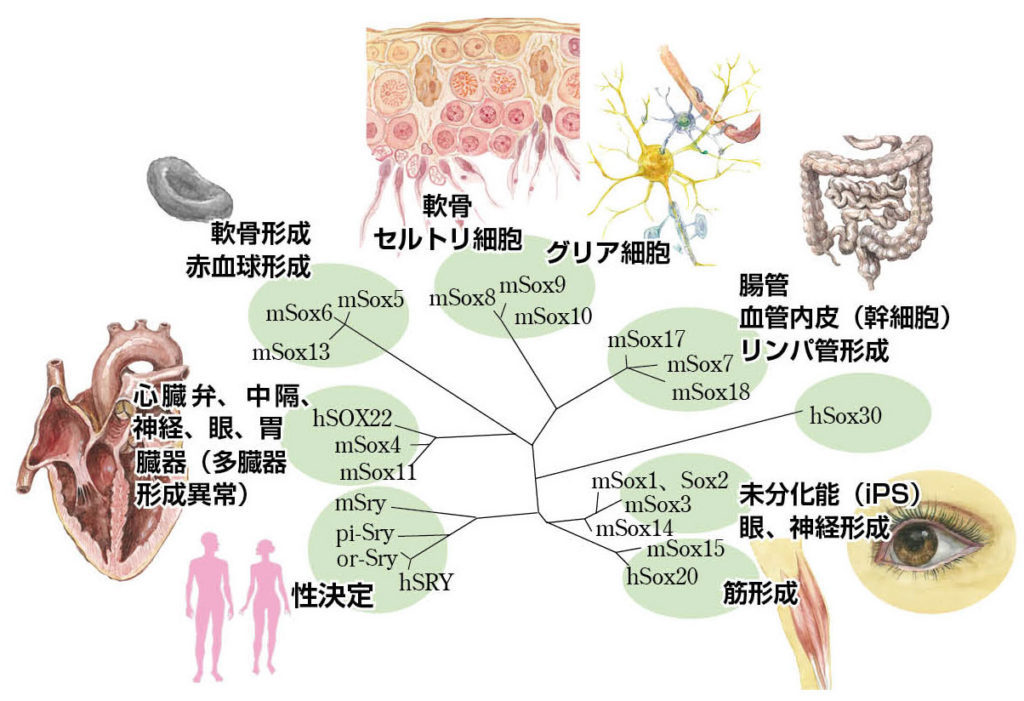
図3.SRYとSOX遺伝子ファミリーの分子系統樹とその機能 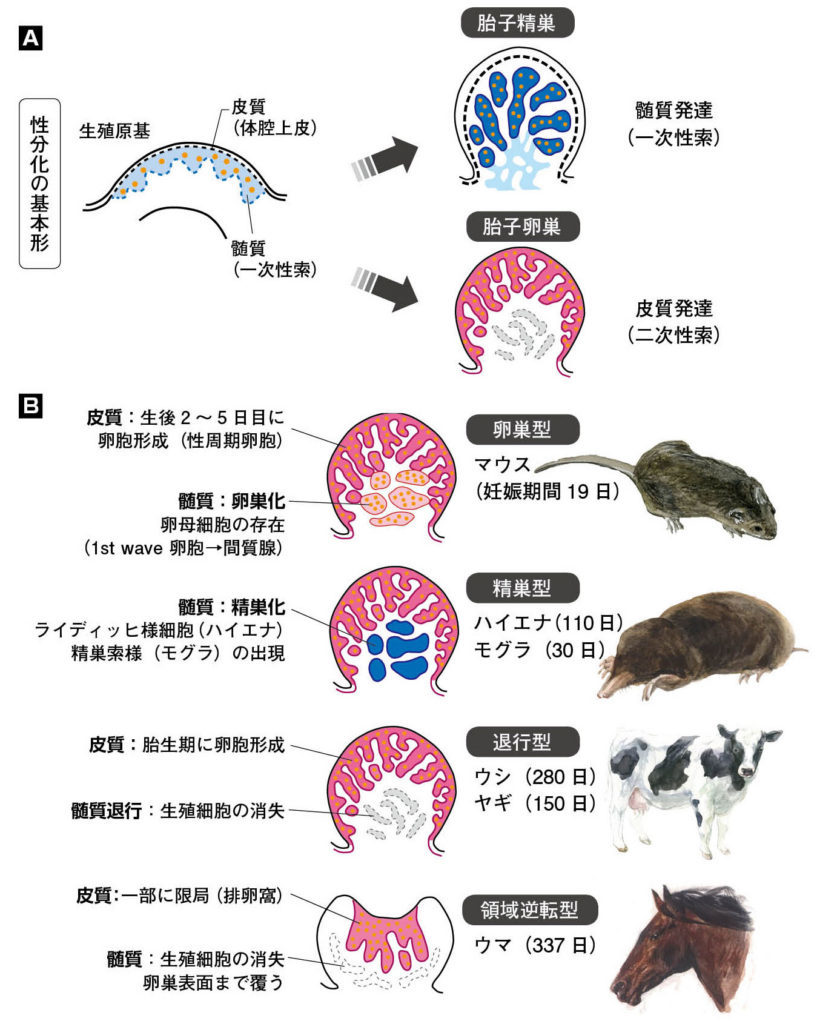
図7.卵巣髄質(一次性索)の分化様式の哺乳動物間での多様性 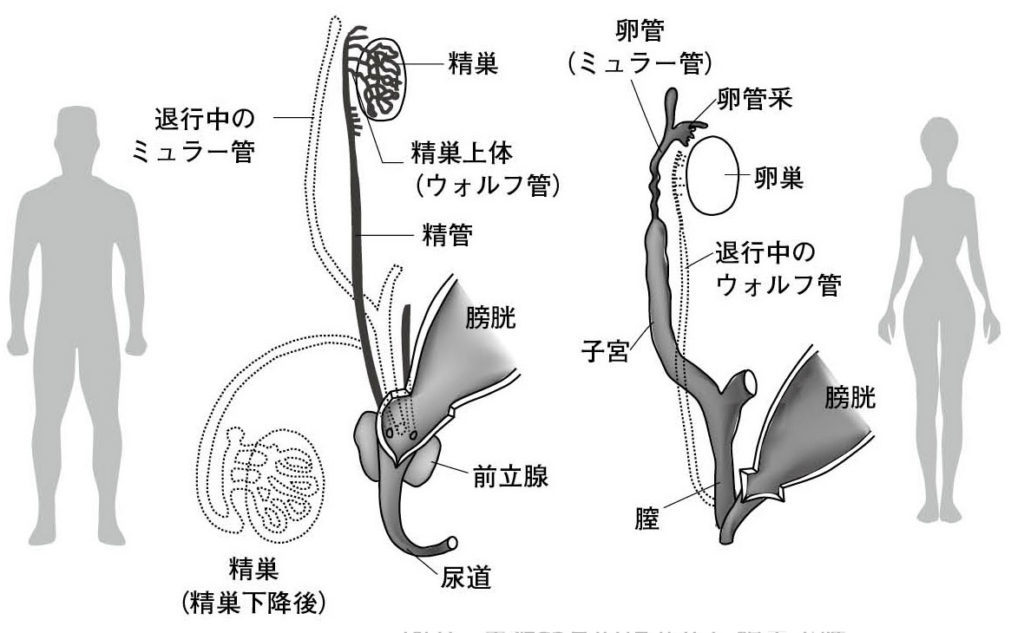
図8.生殖器管の性分化と精巣下降 
図 9.哺乳類の様々な子宮の型 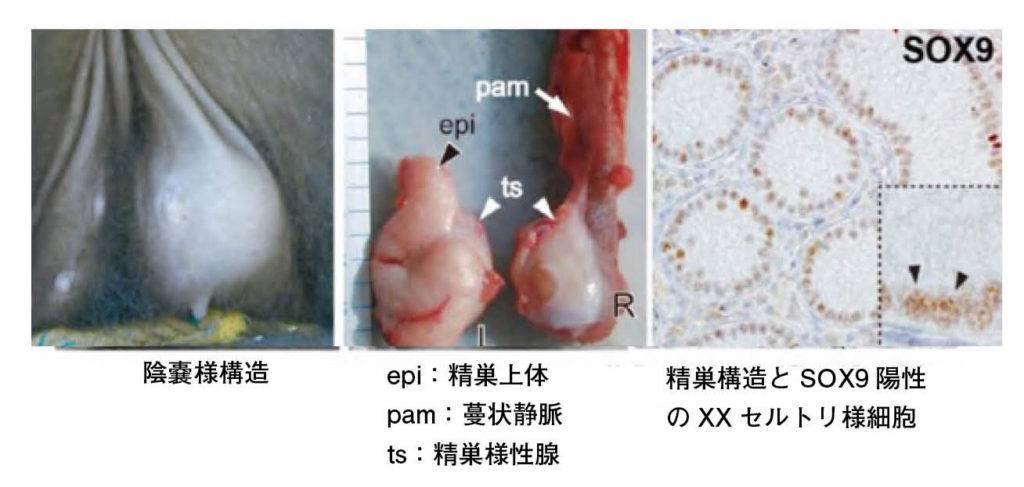
図10.フリーマーチンの卵巣の雄性化の一例 Harikae, Kanai, et.al., J Reported Dev. 2012より 
図11. クモザル(左)とブチハイエナ(右)のメスの陰茎様の外生殖器 クモザル画像:Copyright ©2010-2019 Kenji Nishida / Web National Geographic Japan (©Nikkei National Geographic Inc.)
第6章:哺乳類の脳の性
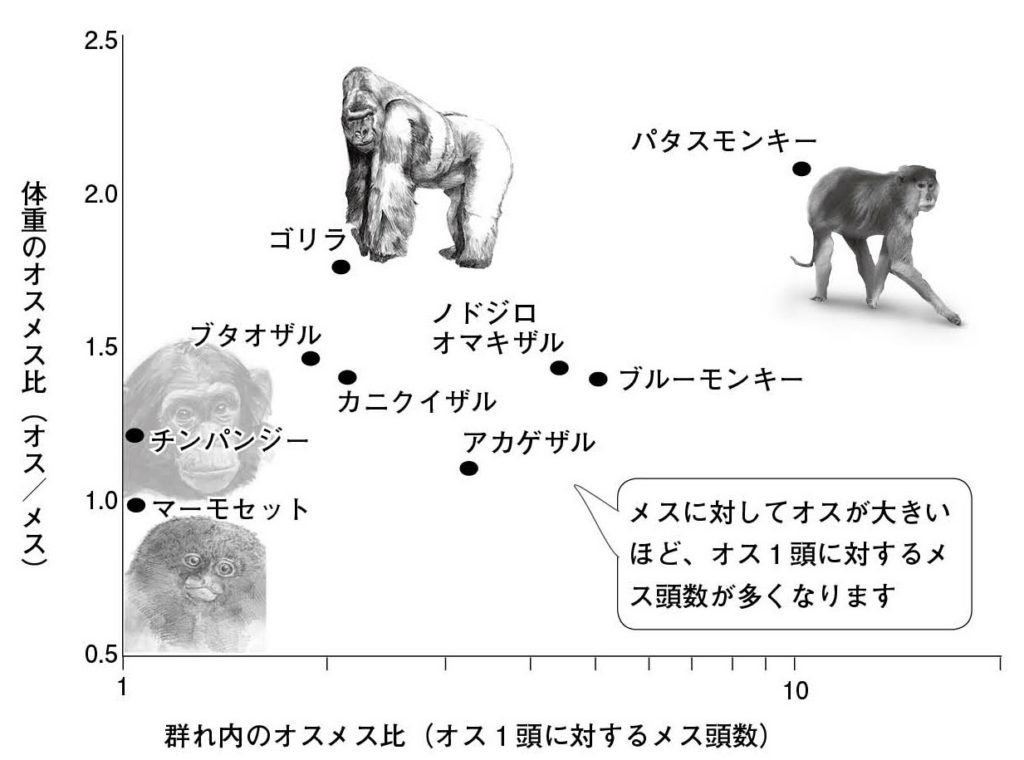
図1.霊長類における群れ内のオスメス比(数字が大きいと一夫多妻)と体重のオスメス比 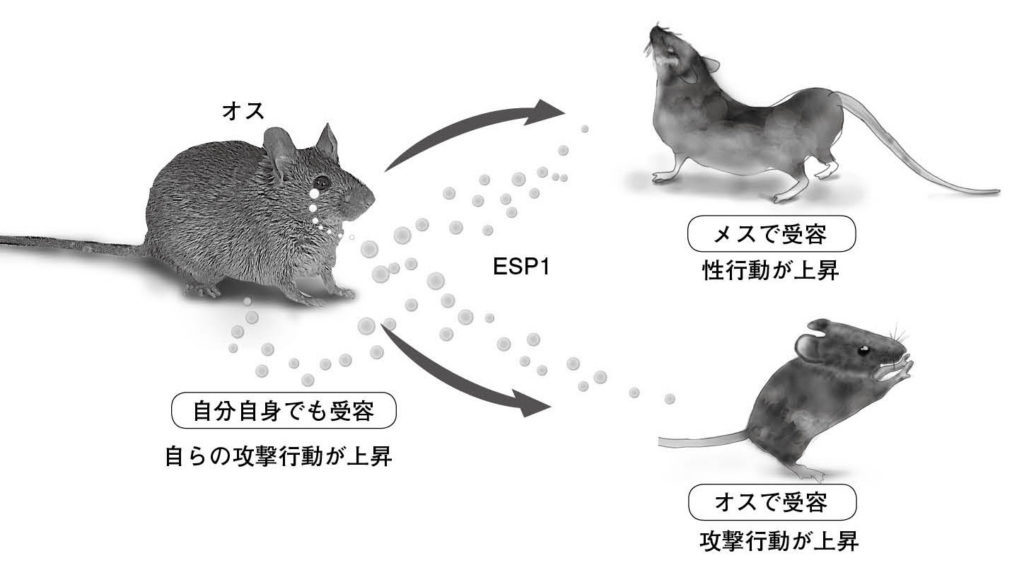
図3.オスマウスの涙腺から分泌されるというESP1が情報を伝える仕組み 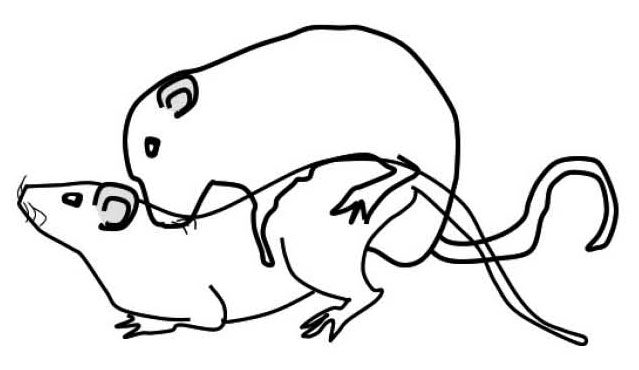
図4.雌雄のラットの交尾行動 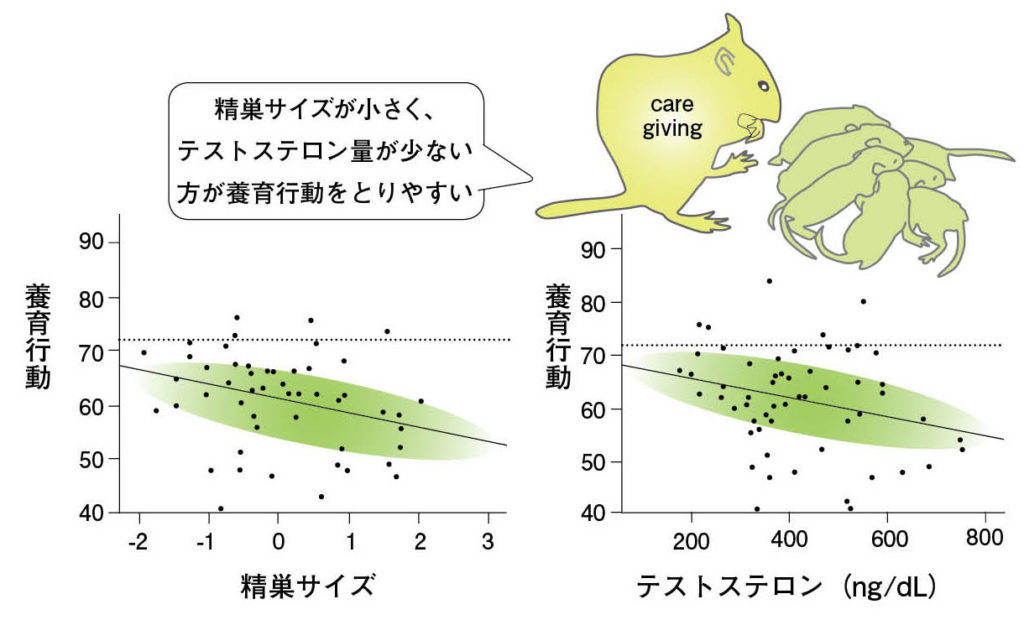
図5.精巣の容積と養育行動の関係を示したデータ 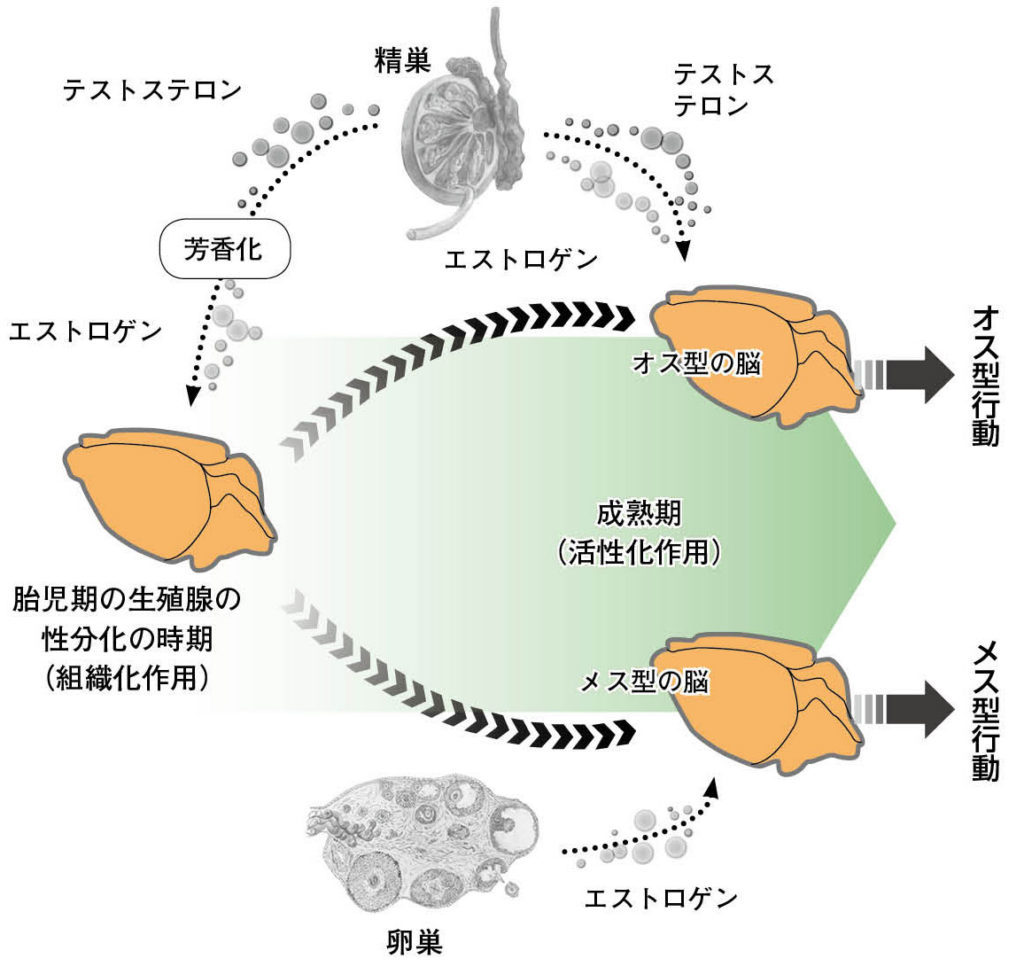
図6.エストロゲンが齧歯類のオス型の神経回路をつくる 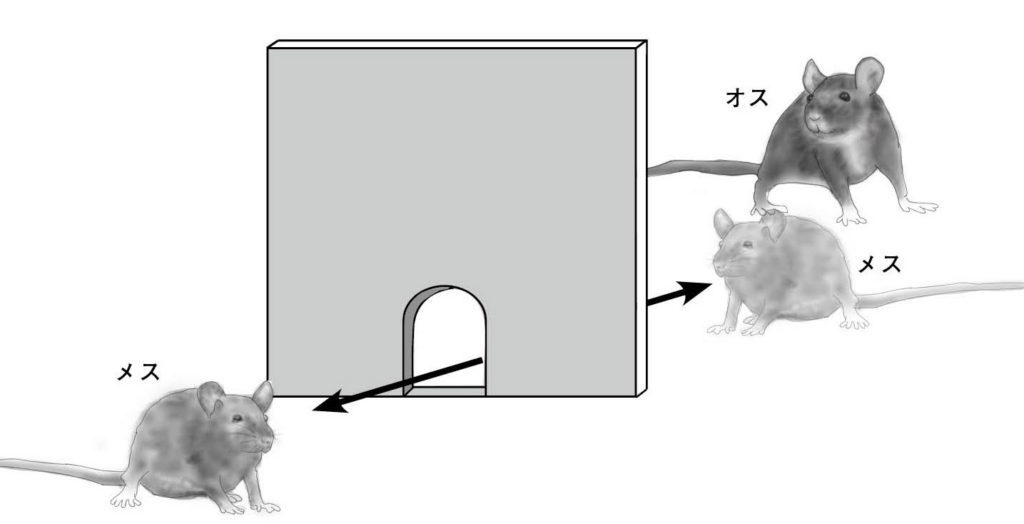
図7.ラットペース配分行動 メスはふたつの部屋を自由に行き来できるが、オスは入口が狭いため、移動できない。メスがマウントや射精のタイミングをコントロールできるため、マウントや挿入の時間が長くなり、射精に至るまでの挿入回数も増える。 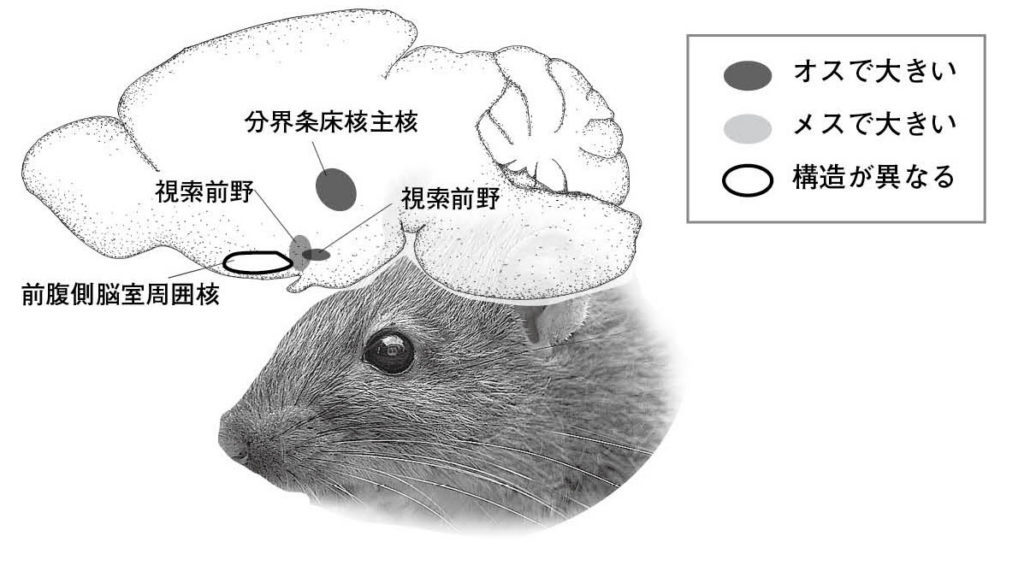
図8.行動や生殖機能の性差に関わる神経核 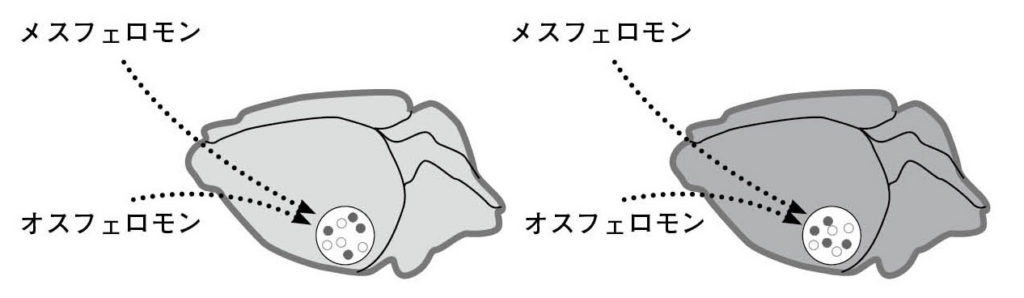
図9.偏桃体内側核におけるオスのフェロモンとメスのフェロモンを伝える神経細胞の分布。異なる細胞がそれぞれオスとメスで役割を担っている。 
図10.「ホルモン(H)ーフェロモン(P)-行動(B)」のサーキット 性ホルモンによって、オスではオス型の行動が、メスではメス型の行動が発現するようになるが、このためには相手からの性シグナルとして性フェロモンを受容しなければならない。この性フェロモンは相手の性ホルモンによって産生、分泌されている。お互いの性フェロモンを受容することで、性行動の誘起のみならず、中枢を介してホルモン分泌が刺激される。 
図11.プレーリーハタネズミのつがい 写真提供:ラリー・ヤング博士(エモリー大学)
第7章:ヒトの性
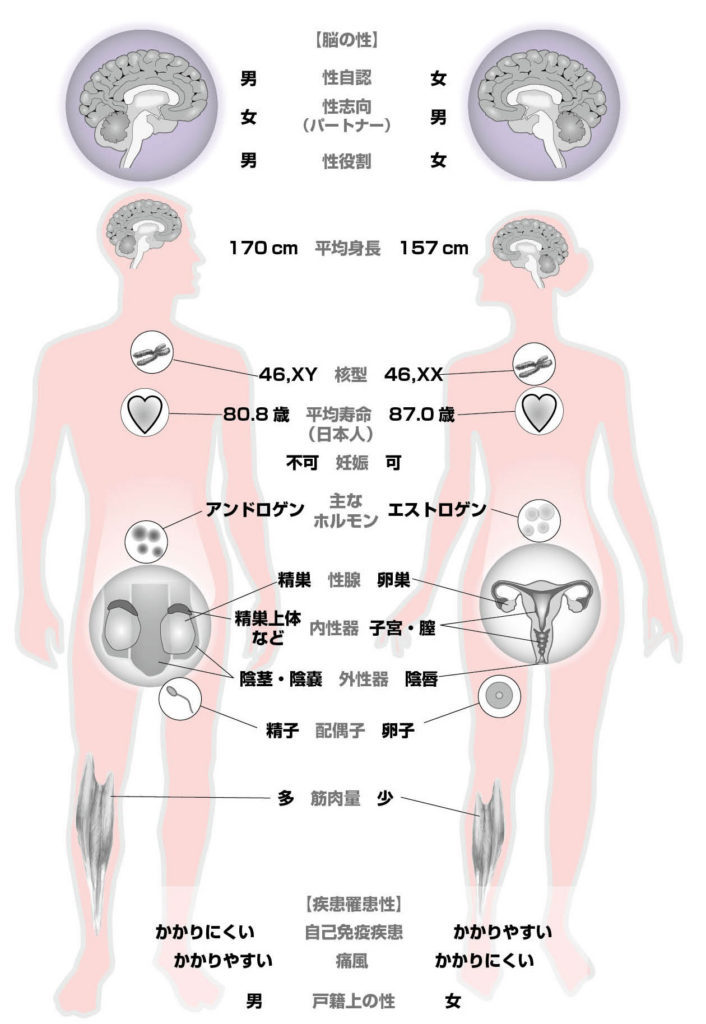
図1.典型的な男女 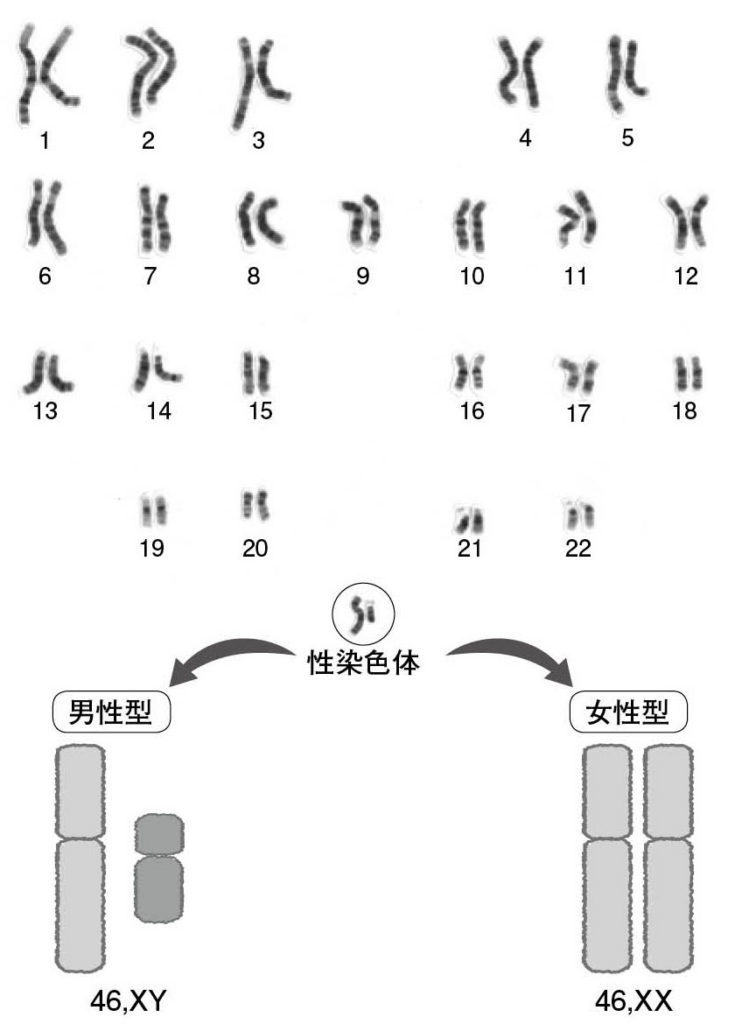
図2.ヒトの染色体 ひとつの細胞には、44本の常染色体と2本の性染色体が入っている。典型的な男性の核型は46,XY、典型的な女性の核型は46,XX である。 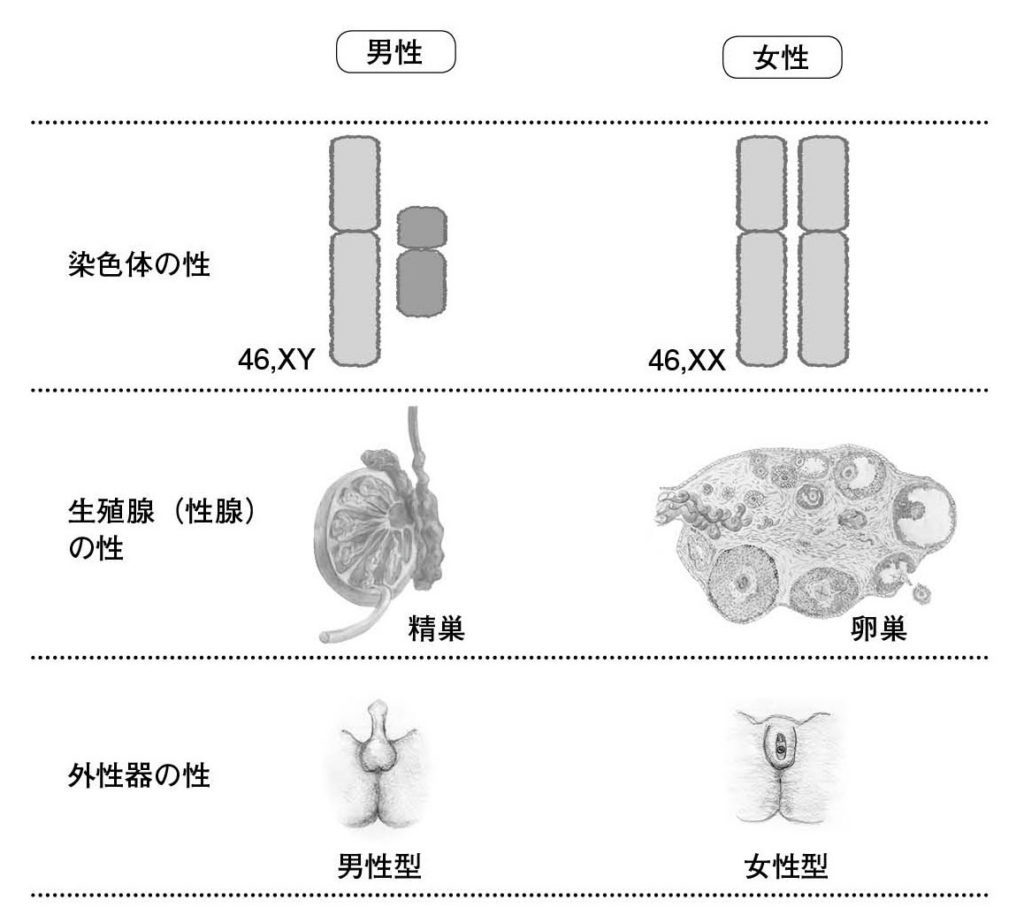
図3.染色体の性、生殖腺の性、外性器の性 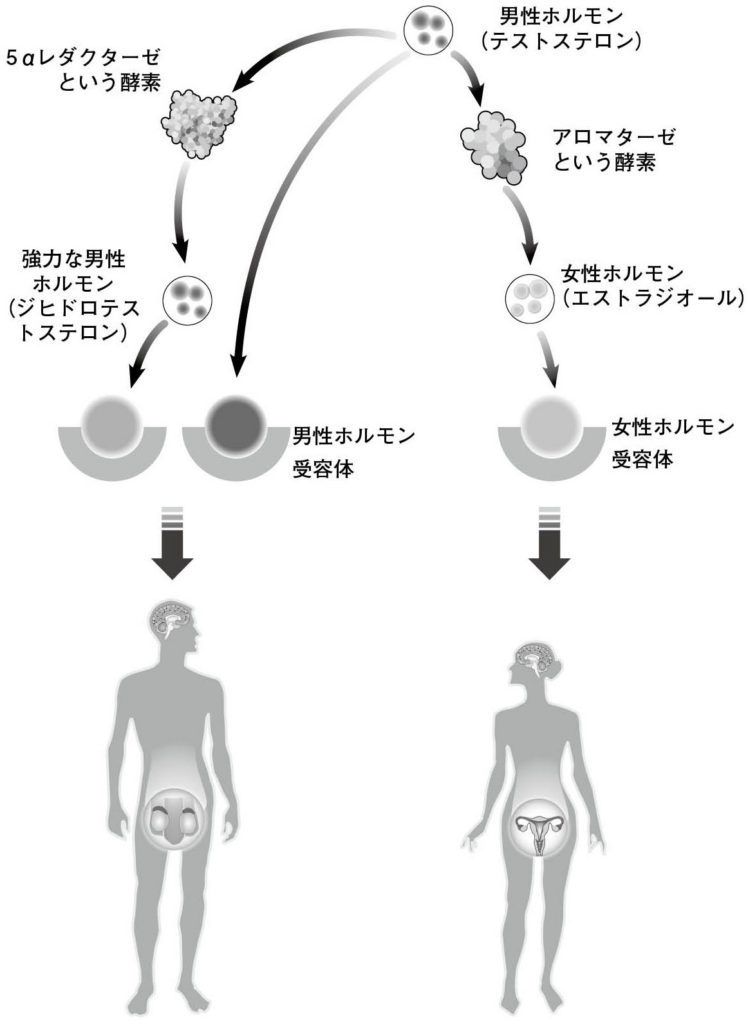
図4.性ホルモンの作用 性ホルモンは受容体に結合して機能を発揮する。 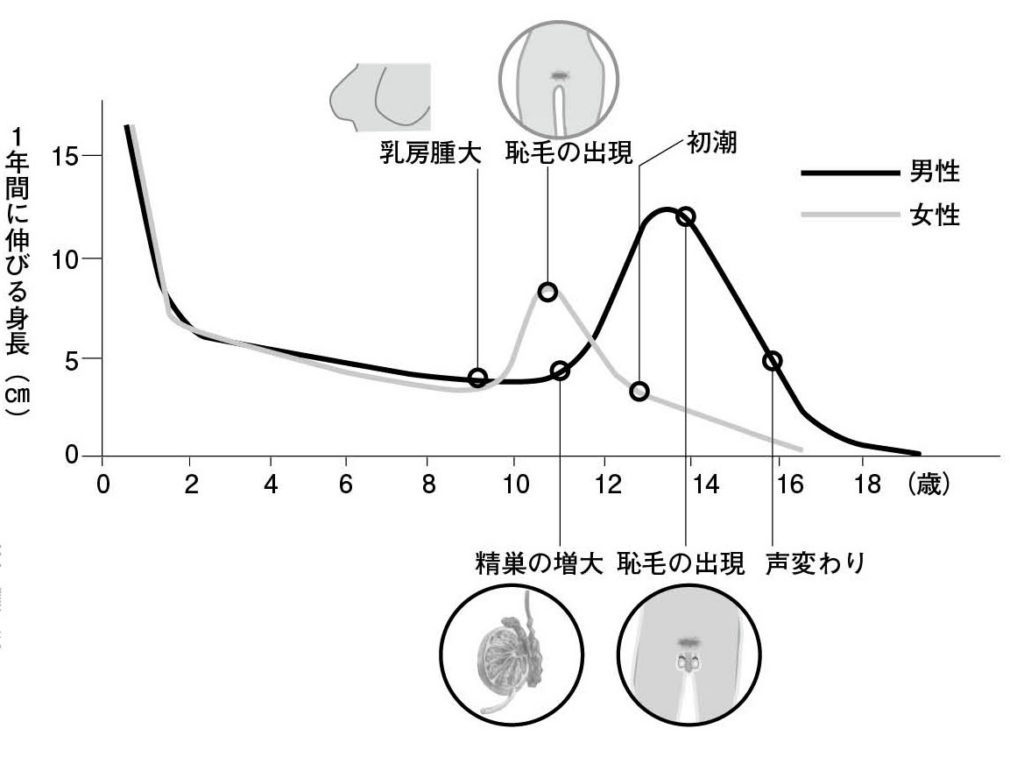
図5.ヒト男女の成長パターンの違い 文献2より引用、改変 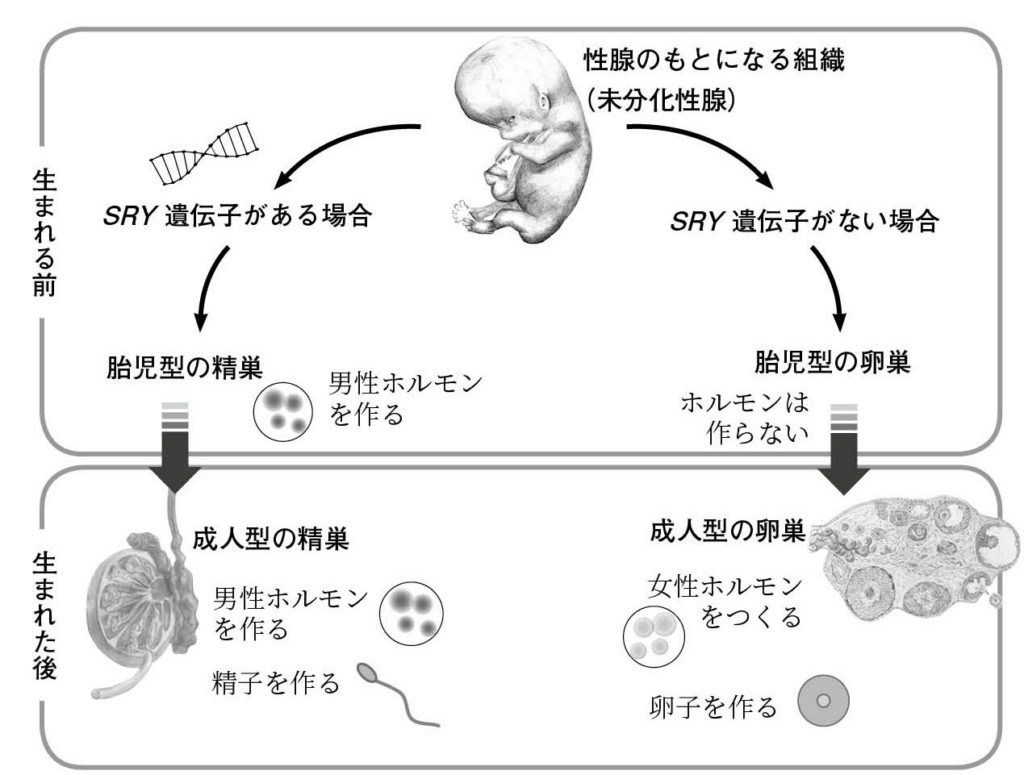
図6.ヒト性決定のメカニズム 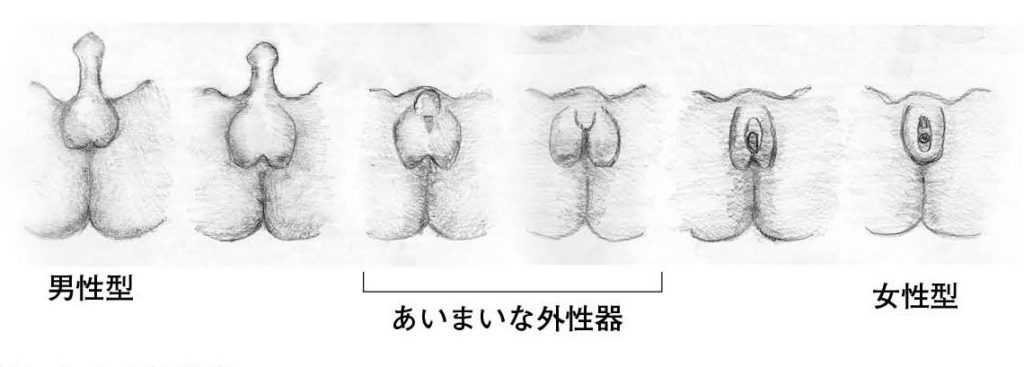
図7.ヒトの外性器 典型的な男性型と女性型に間には、さまざまなバリエーションが存在する。 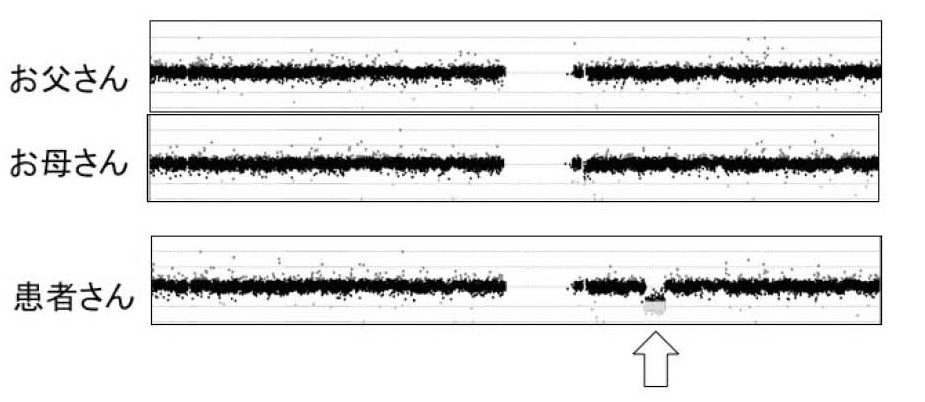
図9.患者さんで見つかった染色体の変化の例(アレイCGHという検査による) お父さんとお母さんには異常がないが、患者さんでは染色体の一部(矢印)が欠けている。 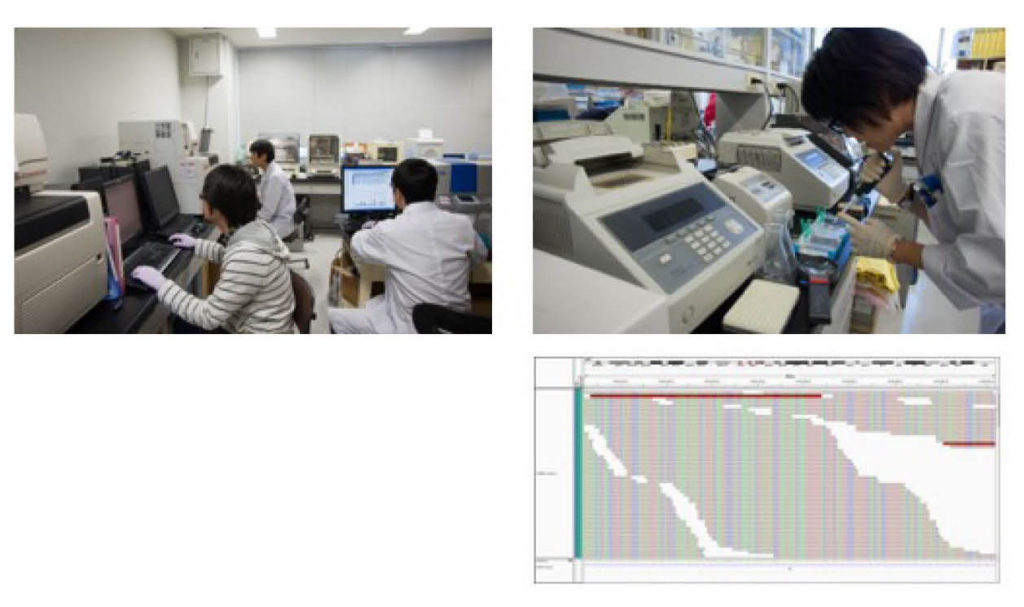
図10.性分化疾患患者さんの遺伝子診断 遺伝子解析をしている様子(上)と次世代シークエンスの結果の例(右)。
第8章:昆虫の性

図1. カイコの幼⾍と成⾍ 上段:カイコの5齢幼⾍。この写真のカイコは限性系統であり、メスに斑紋がある。 中段・下段:カイコの成⾍。左がメスで、右がオスである。メスには腹部末端にフェロモン腺があるが、オスにはない。 
図2. dsx遺伝⼦の性特異的なスプライシング カイコのdsx遺伝⼦Bmdsxを例に⽰している。Bmdsxは5つのエキソンから構成されメスではすべてのエキソンが使⽤されるが、オスでは1, 2, 5の3つのエキソンしか使⽤されない。その結果、開始コドンは同じ場所であるが、終⽌コドンの出現する場所が異なるため、雌雄で異なるBmDSXタンパク質が作られる。 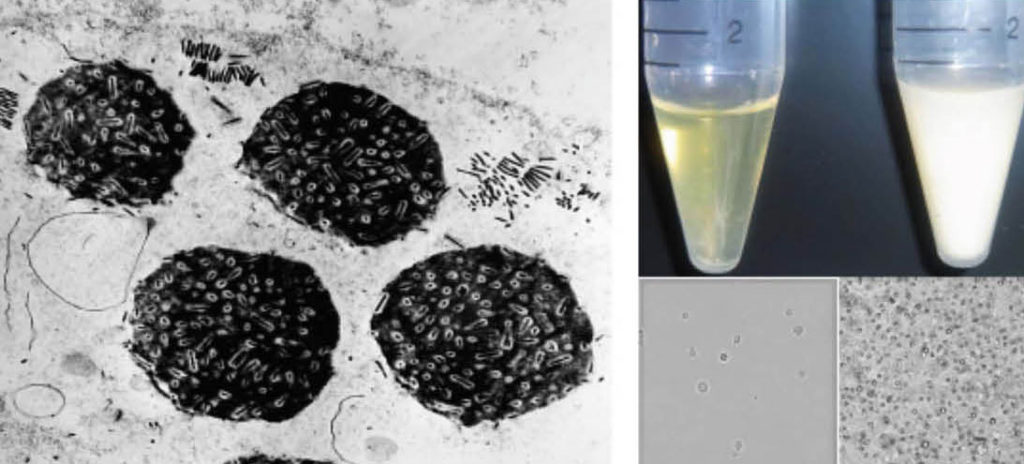
図3. カイコに感染するバキュロウイルス 左図はカイコ核多⾓体病ウイルスが形成する多⾓体の電⼦顕微鏡写真(⼩林正彦博⼠提供)。感染細胞の核内に光学顕微鏡で観察できる⼤きさの封⼊体を形成し、その中に数百のウイルス粒⼦を形成する。右図はウイルスに感染したカイコの⾎液。ウイルスに感染していない健康なカイコの⾎液(左)は透明で⾎球が観察されるが、ウイルス感染カイコの⾎液は⽩濁し、多⾓体のみしか観察できない。この驚異的なタンパク質⽣産能⼒を利⽤したものが、バキュロウイルスベクターである。 
図4. カイコの限性⿊卵系統の卵 限性⿊卵と呼ばれるカイコの系統では、メスの卵が⿊⾊、オスの卵が⽩⾊であるため、卵の段階で雌雄が鑑別できる。 提供:⽊内隆史博⼠ 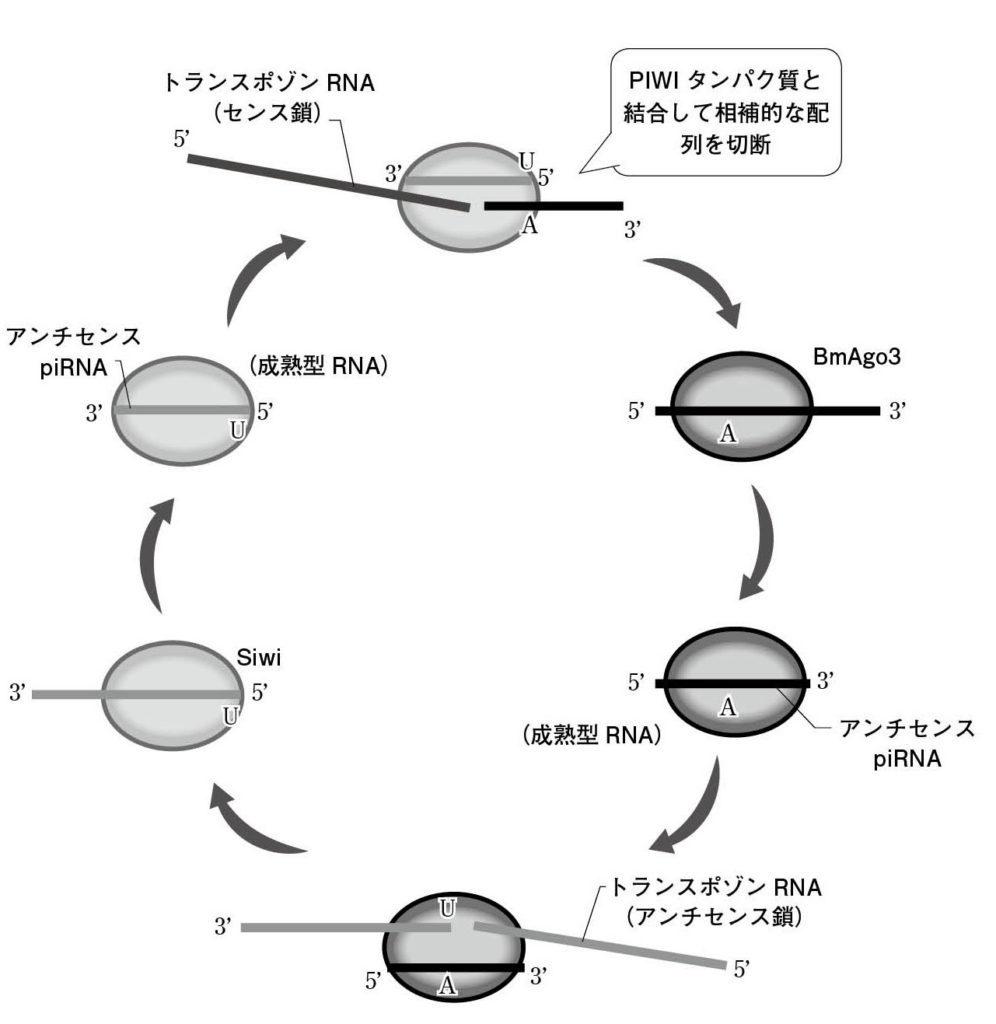
図6. piRNAのピンポンサイクル カイコのピンポンサイクルを例として示している。このサイクルでは、ふたつのPIWIタンパク質SiwiとBmAgo3がそれぞれアンチセンスpiRNA、センスpiRNAと複合体を形成して、トランスポゾンRNAを切断する。切断は5’端から10塩基目と11塩基目の間で起きる。切断されたRNAの3’断片は他方のPIWIタンパク質と結合し、成熟型piRNAとなる。つまり、ピンポンサイクルが稼働するとトランスポゾンが抑制されるが、それと同時にpiRNAが産生される。 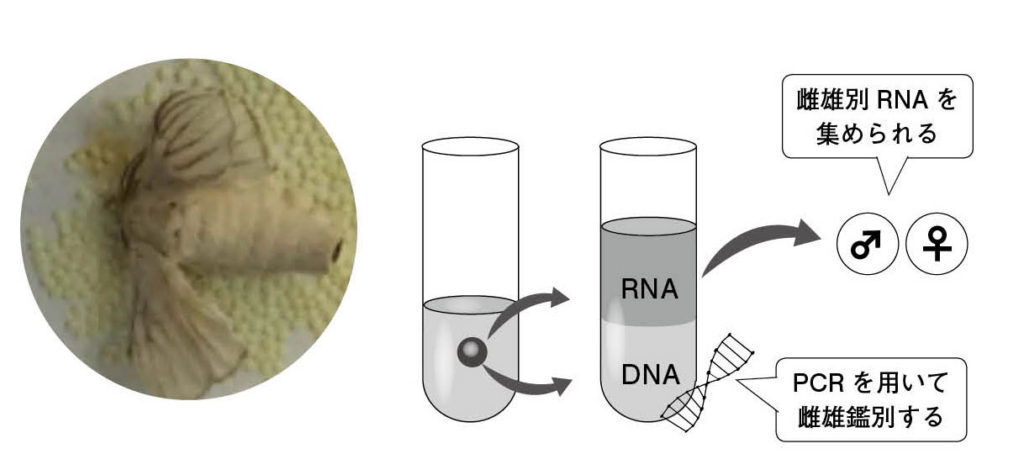
図7. カイコの卵のオスとメスを鑑別して、雌雄のRNAを集める⽅法 カイコの卵ひとつからDNAとRNAを抽出する。DNAを⽤いてW染⾊体の有無を調査し、卵の性別を鑑別する。そのDNA鑑定の結果から、雌雄別でRNAを集めることができる。 
図9. カイコの祖先種であると考えられているクワコ(桑蚕) 幼⾍は普通のカイコとは異なり褐⾊であり(左上図) 、枝に擬態することもある(右上図)。成⾍はカイコと異なり、⾶翔できる(下図) 。 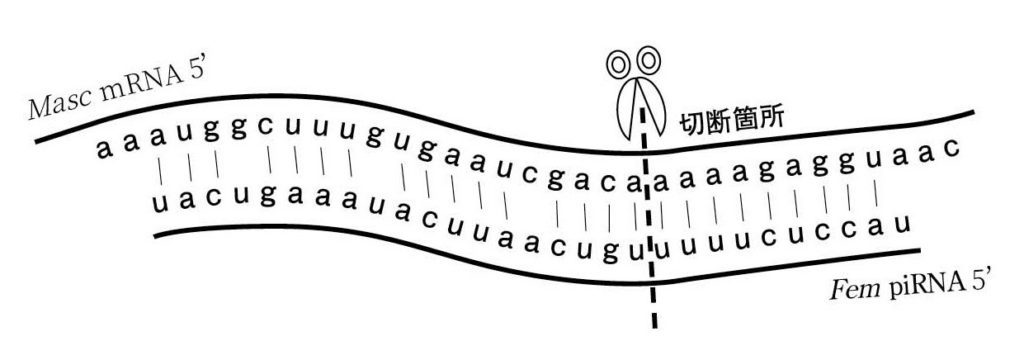
図11.Fem piRNAに相補的なZ染⾊体上の配列 Fem piRNAはZ染⾊体から転写されるMasc mRNAと26/29で⼀致している。piRNA-PIWI複合体は5’から10塩基⽬と11塩基⽬の間を切断することが知られている。胚⼦由来のmRNAを⽤いた実験から、この箇所でMasc mRNAが実際に切断されていることが明らかになっている。 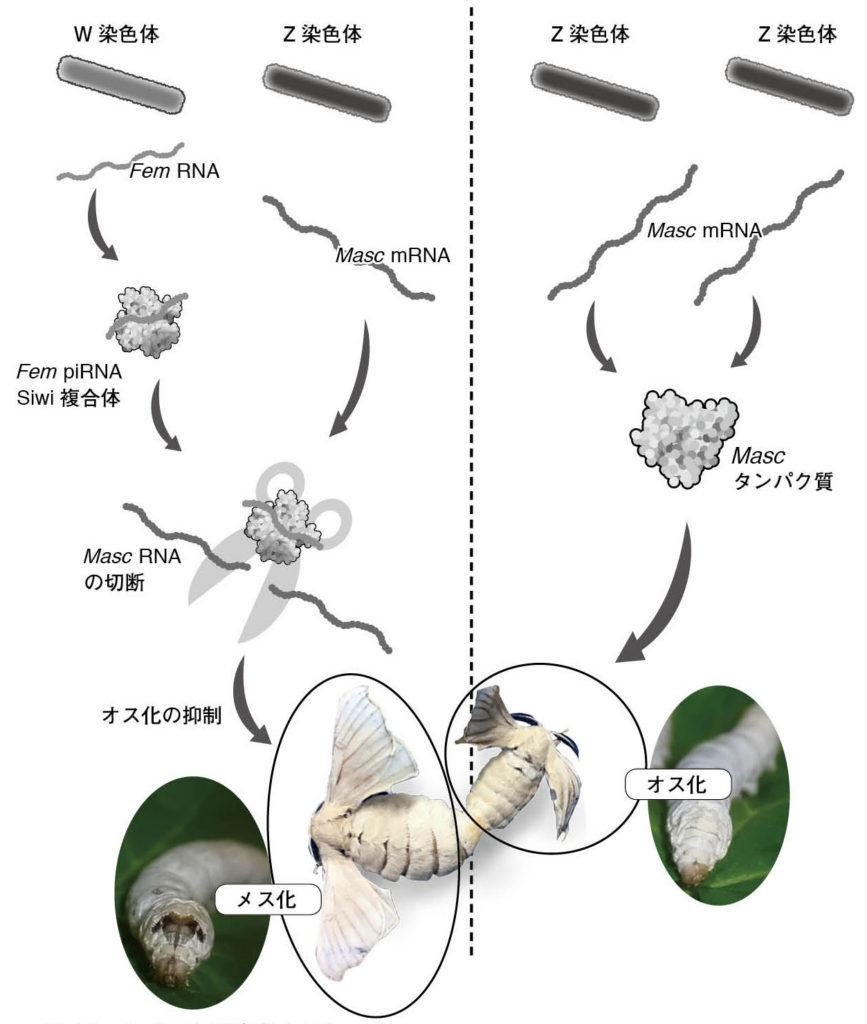
図14.カイコの性決定カスケード メスにおいては、W染⾊体からFem RNAが転写され、Fem piRNAとSiwiの複合体が形成される。この複合体はZ染⾊体から転写されるオス化遺伝⼦MascのmRNAを切断し、オス化を抑制することでメス化を誘導する。⼀⽅、オスではW染⾊体がないためMasc mRNAは抑制を受けず、オス化が誘導される。 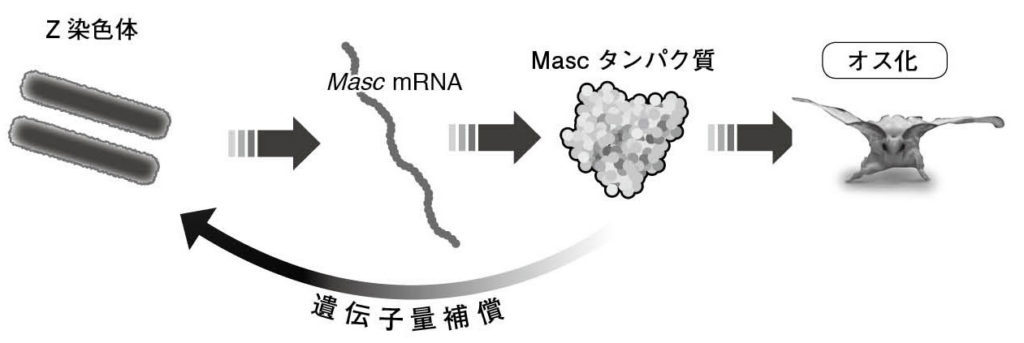
図15.Mascタンパク質は⼀⼈⼆役を果たす分⼦である Mascタンパク質は、オス化カスケードの最上位因⼦であるとともに、Z染⾊体からの遺伝⼦の転写量を半分にする遺伝⼦量補償も担っていることがわかった。 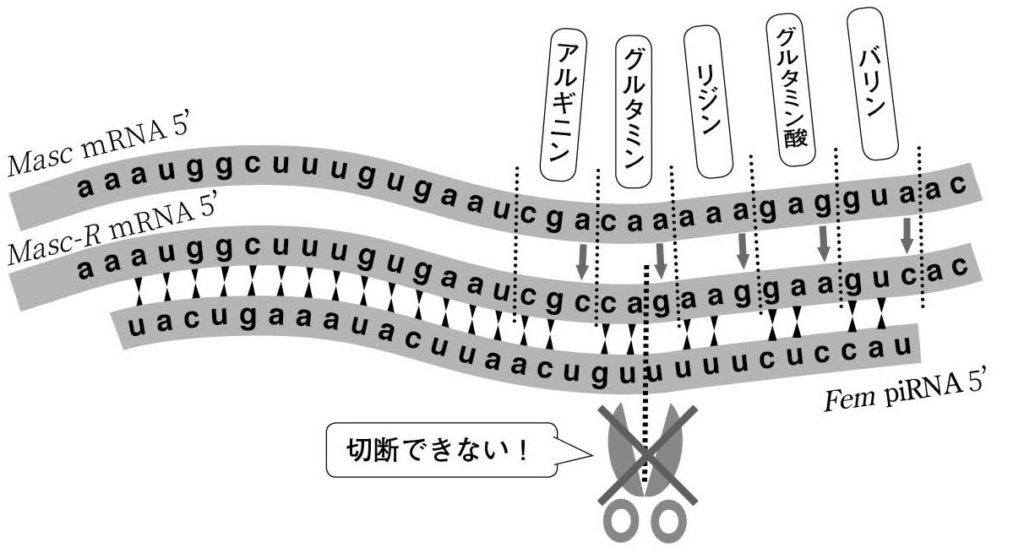
図16.Fem piRNA-Siwi複合体で切断を受けないMasc (Masc-R)の設計 piRNA-PIWI複合体は5’から10塩基⽬と11塩基⽬の間を切断するが、このとき1から10塩基⽬が完全に⼀致していることが必要である。また、コドンの3塩基⽬は塩基を変えても同じアミノ酸をコードすることが多いため、Mascタンパク質のアミノ酸を変化させずにFem piRNA-Siwi複合体で切断を受けない⼈⼯オス化遺伝⼦Masc-Rを設計することができる。 
図17. エリサンの成⾍ エリサンはヤママユガ科に属する⼤型の昆⾍である。性染⾊体構成はZ0/ZZであり、カイコ(ZW/ZZ)とは異なる。 提供:川本宗孝⽒ 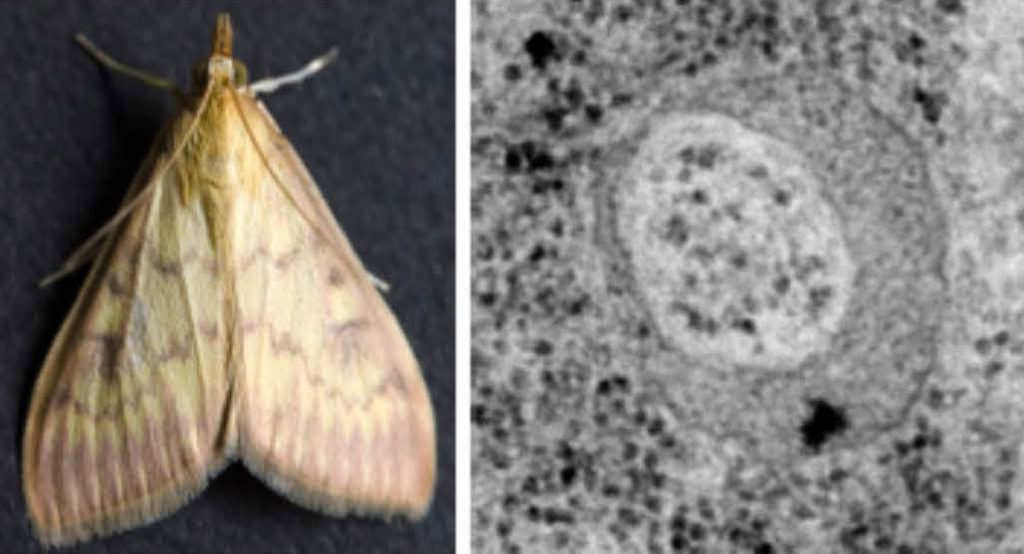
図19. アワノメイガとボルバキア 左:トウモロコシの害⾍であるアワノメイガ。 提供:川本宗孝⽒ 右:アワノメイガの卵巣におけるオス殺しボルバキアの電⼦顕微鏡写真。 提供:福井崇弘⽒、⽯綱史⼦博⼠ 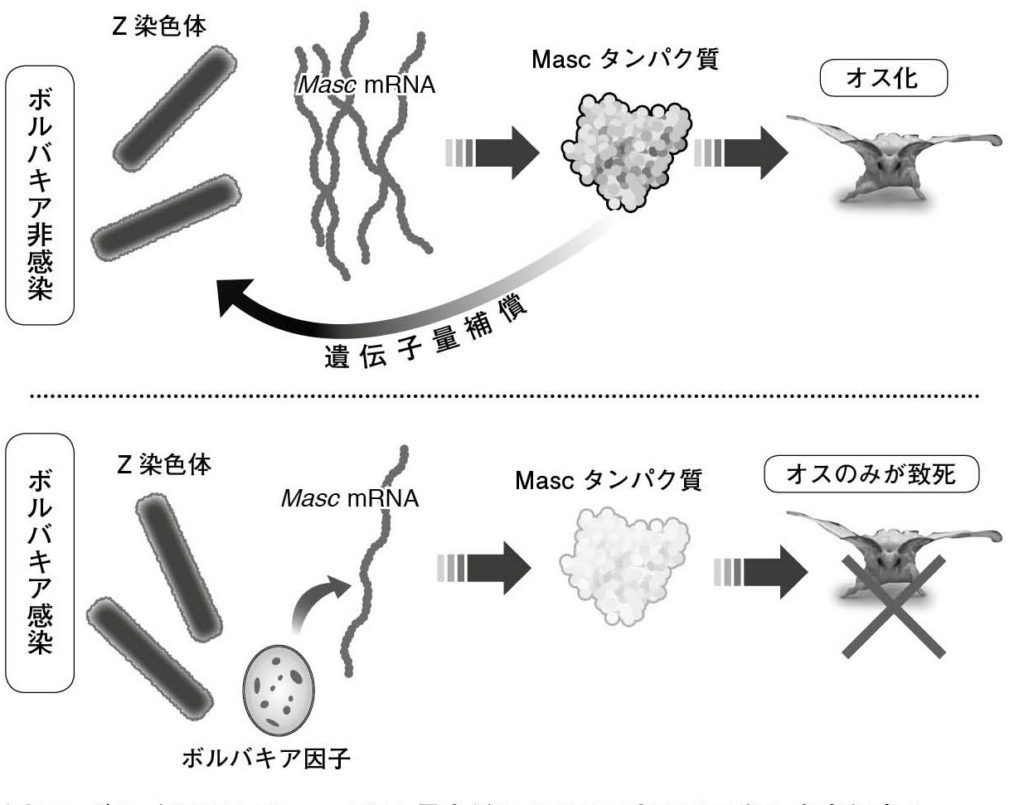
図20. ボルバキアはMasc mRNA量を低下させることでオス殺しを実⾏する ボルバキア⾮感染胚⼦では、Mascタンパク質によりオス化と遺伝⼦量補償のカスケードが稼働する。⼀⽅、ボルバキアに感染すると、未知のボルバキア因⼦の働きでMasc mRNA量が低下し、その結果、遺伝⼦量補償が破綻し、オスが死に⾄る。 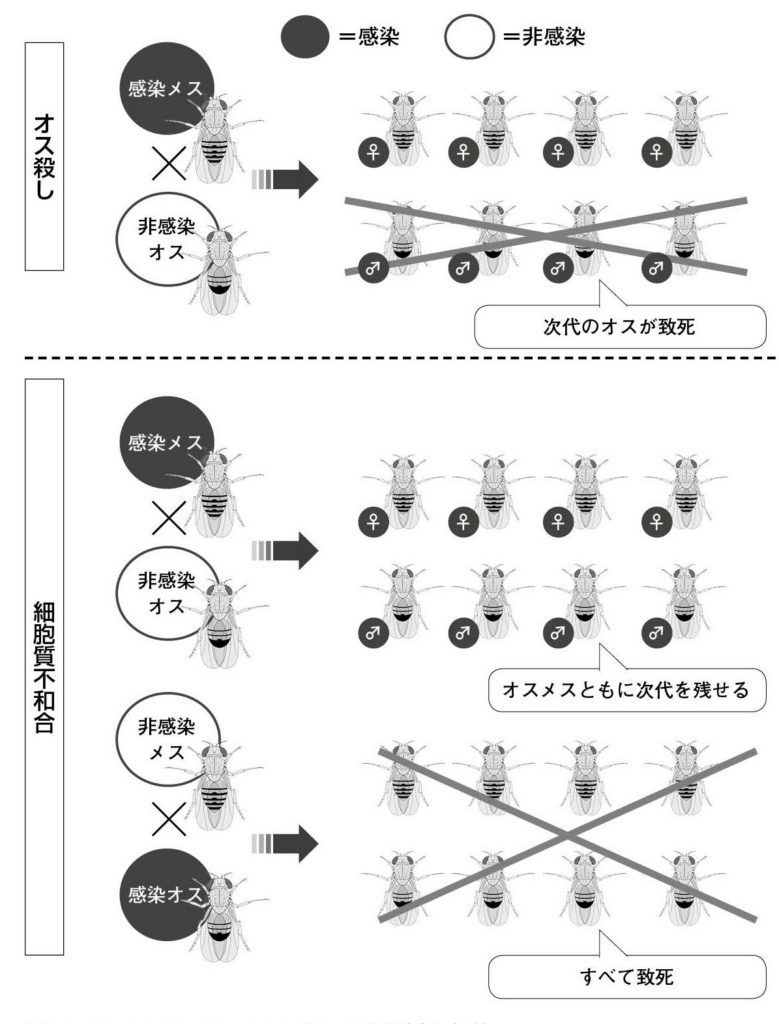
図21. ボルバキアによるオス殺しと細胞質不和合 オス殺しボルバキアに感染したメスは、次代でオスのみが致死する。⼀⽅、細胞質不和合を起こすボルバキアに感染したメスは、次代を残すことができるが、⾮感染メスと感染オスの交配では、次代が残せない。いずれの場合も、ボルバキア感染個体の割合を増やす戦略である。
第9章:植物の性

図6.マメガキ (Diospyros lotus) の雌雄個体 植物では初めて性別決定遺伝子が同定された個体。カキ属の雄花は複数(普通は3つ)の花から構成される花序を示すが、雌花は単一の花から構成される。 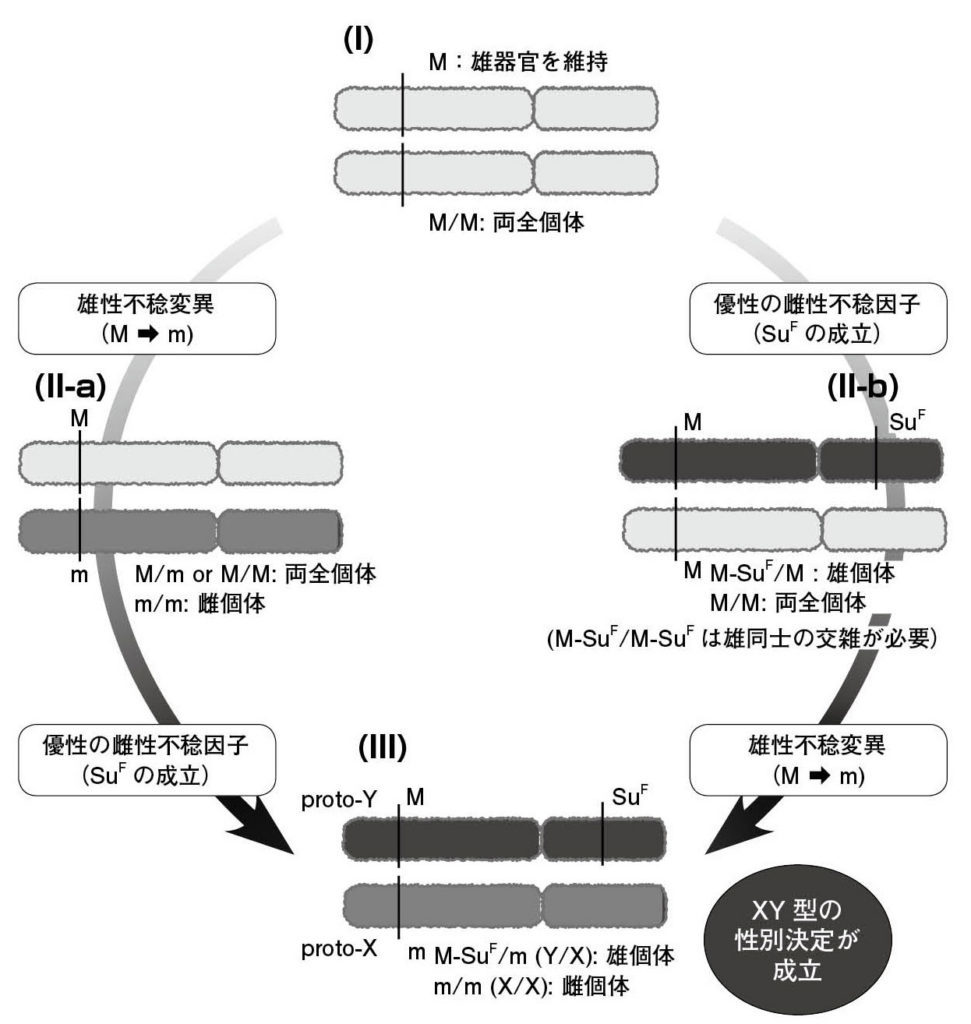
図5.植物の性別を成立させる二因子モデル デボラ・チャールズワース博士らが提案した二因子モデルによるXY型性決定機構の成立過程。(I) 被子植物の祖先は両全性であり、ここでは雄しべの機能を維持する因子 (M) に着目している。(II-a) M遺伝子における機能変異により、雌花両性花異株性 (ginodioecy) となる。 進化理論上起こりやすい変異である。(II-b) 両全性から雌しべの機能を抑制する遺伝子 (SuF) の成立により雄花両性花異株性 (androdioecy) になる。理論上は起こりにくい。 (III) M遺伝子の変異 (M→m) SuF遺伝子の新規成立の両者がそれぞれX, Y染色体(と将来なるもの)の上で生じると、性別(オス・メス個体)を発現することができる。 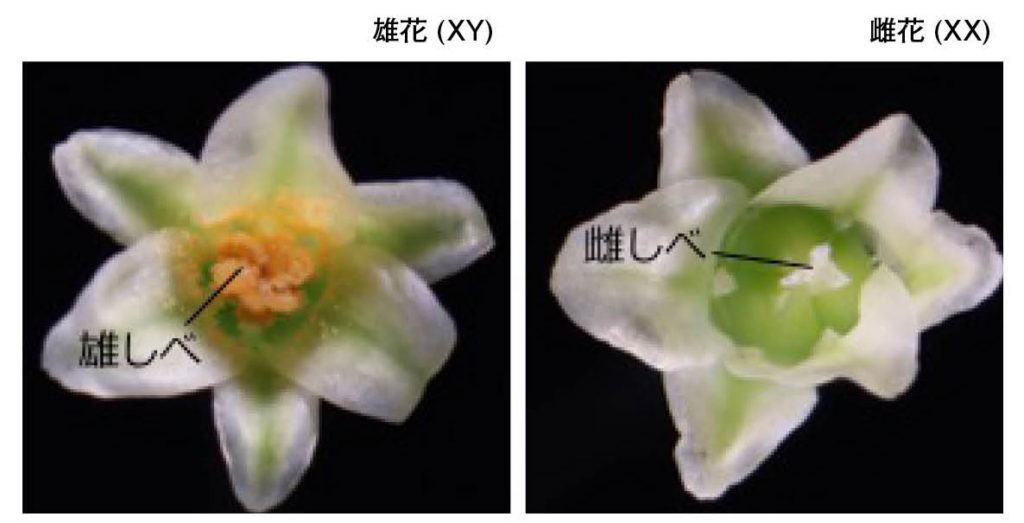
第10図:食用アスパラガス (Asparagus officinalis) の雌雄花 提供:東北大学・菅野明博士 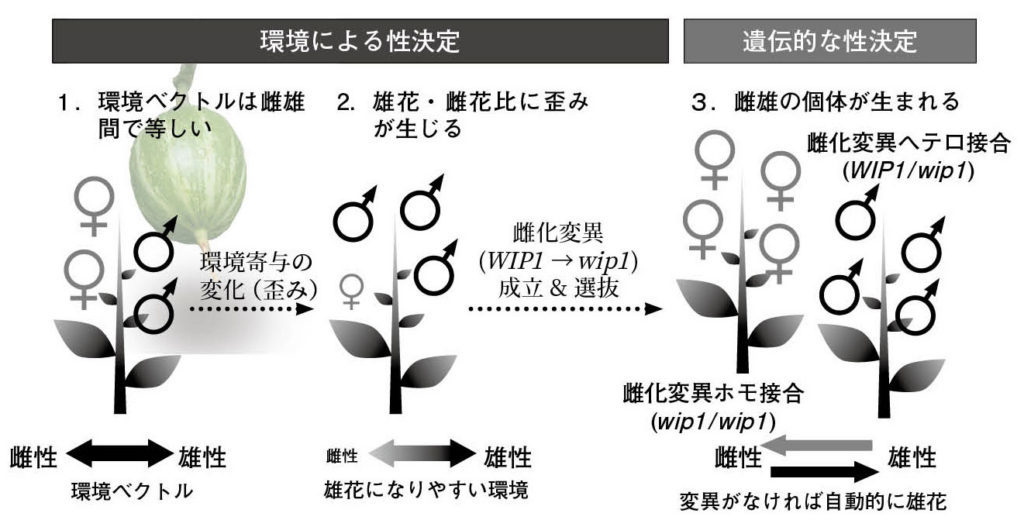
図9.雌雄異花同株を出発点とした一因子モデルによる性別の成立過程 1.雌雄異花同株では、個体内の花単位の性は内的な環境ベクトルに依存しており、これが偏っていないうちは雌雄の花が同じ程度着生する。この状態は環境的性決定と定義される。 2.内的な環境ベクトルが雌雄のどちらかに偏ることがある。ここではACC11がほぼOFFになってWIP1が強く作用し、雄花に偏った例を示した。 3.性比の歪みへの適応進化として、その歪みと逆のベクトルを持つ新規遺伝子変異が成立・選抜される。内的ベクトルは遺伝的因子の影響を補正する方向に固定されて性別が確立される。 
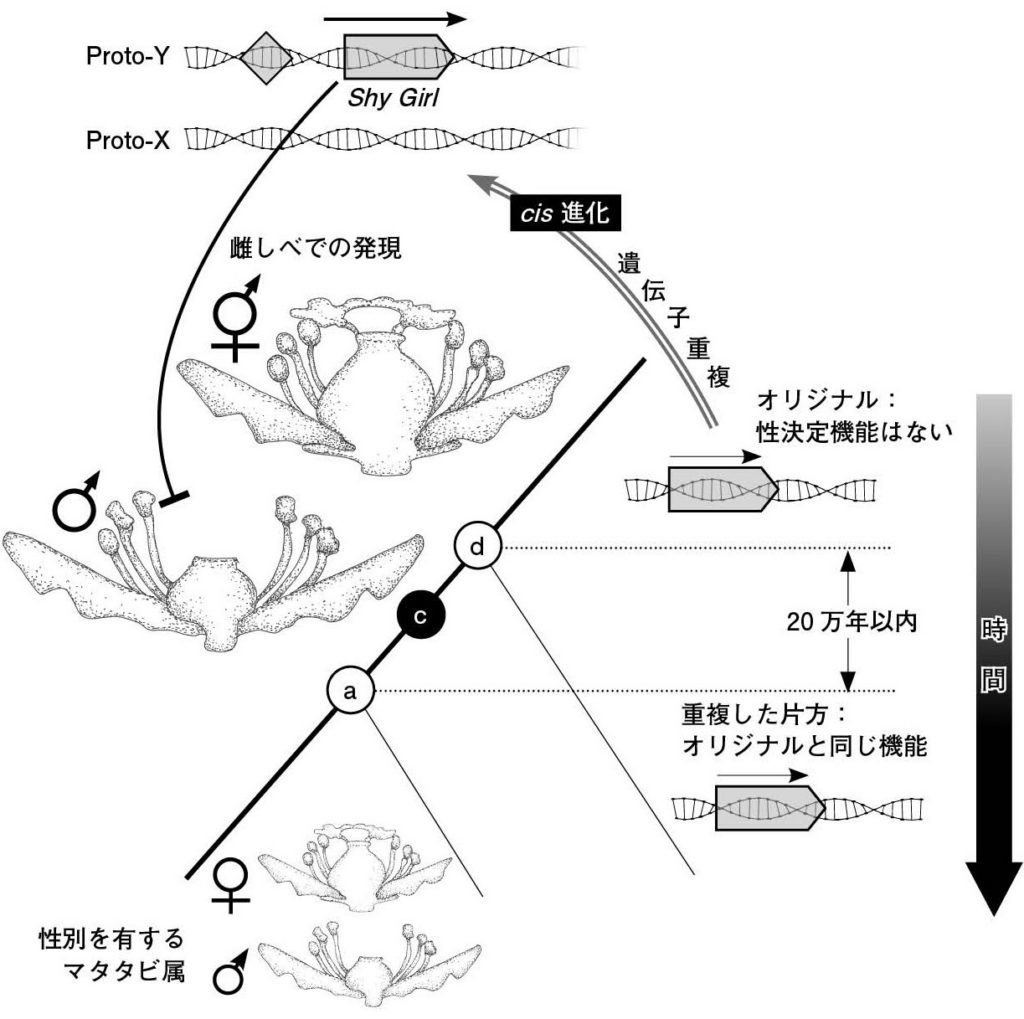
図16.ヒロハノマンテマ (Silene latifolia) の雌雄花 提供:理化学研究所・風間裕介博士 
図14.キウイフルーツの性決定遺伝子Shy Girlの遺伝子組み換えによるタバコのオス化 Shy Girl遺伝子は雌しべの抑制機能を持つため、タバコに導入することによって雌しべの委縮した雄花が出現する。 
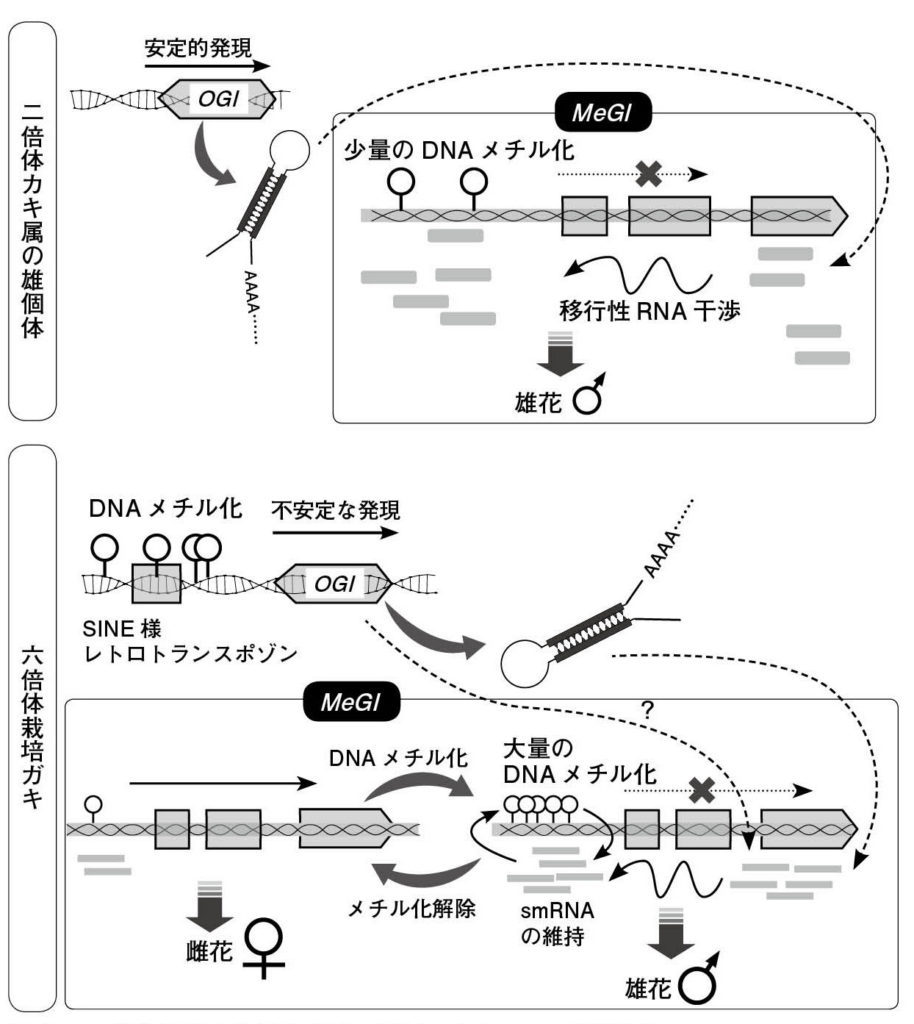
図13.キウイフルーツ (Actinidia spp.) の雌雄花 
図18.パパイヤの雌花・両性花・雄花 パパイヤは本来は雌雄異株性であり、両性花は存在しない。オス個体 (XY) のY染色体に存在するふたつの性決定遺伝子のうち、片方(SuF因子)に変異が生じたYh染色体と呼ばれる性染色体を持つことで両性花が着生する。 提供:イリノイ大学・レイ ミン博士 
図17.黒穂病菌の感染によるヒロハノマンテマの性転換 雌花に黒穂病が感染することにより、雌しべが委縮し、雄しべが形成される。しかし、雄しべに正常な花粉は形成されず、葯からは黒穂病菌にまみれた粒子が放出される。 提供:東京大学・藤田尚子博士、河野重行博士 
図21.1万2000年を生きる世界一巨大な木 カリフォルニア州のヨセミテ国立公園(マリポサグローブ)にあるジャイアントセコイアの木。筆者が2013年に撮影したもの。樹齢12000年を超えると言われており、その幹の太さは12m以上、矢印で示した幹の「太さ」が3m以上もある。写真の下の方にいる人々は幹から10m以上離れているが、木が巨大すぎて距離感が掴めない。
第11章:多様な性決定システムにみられる共通性
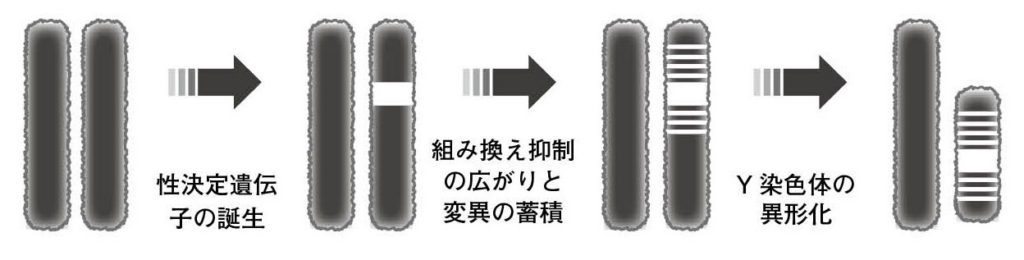
図2.Y染色体とX染色体はもともとは同じ染色体であった。 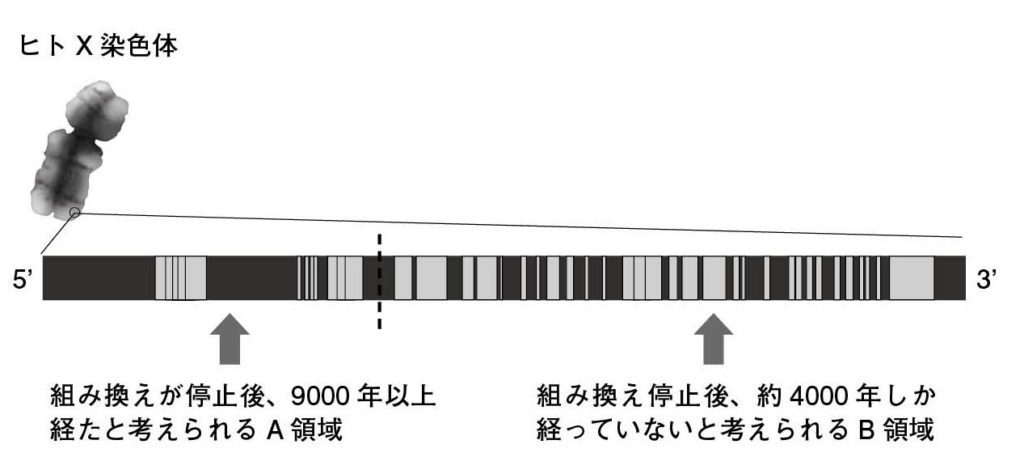
図3.アメロゲニンX遺伝子 ヒトX染色体上のアメロゲニン遺伝子のエクソンイントロン構造を示した。点線より左側はA領域、点線より右側はB領域と名付けられている。 Iwase et al., 2003を参考に作図 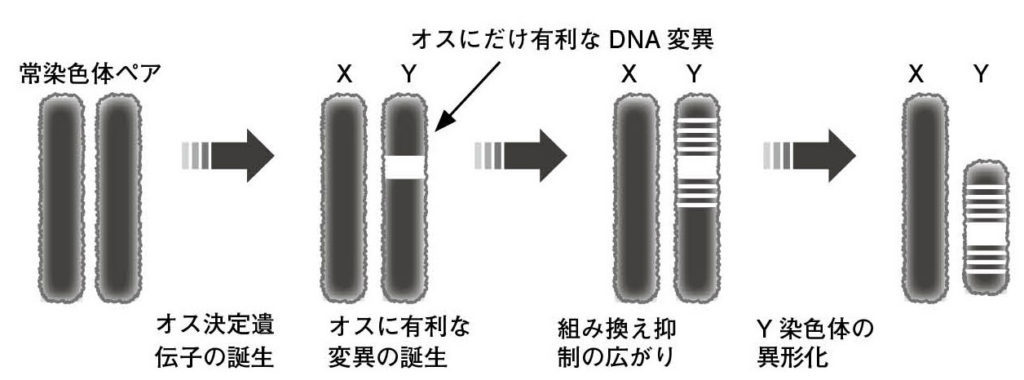
図4.Y染色体に組み換え抑制がおきる究極要因 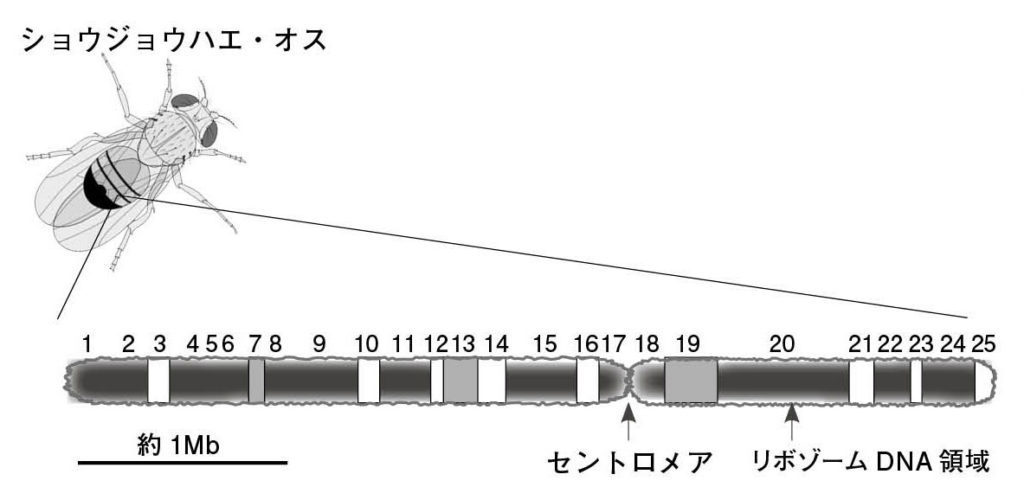
図5.ショウジョウハエのY染色体 染色体上にある番号はそれぞれヘテロクロマチン領域を示す。 Hoskins et al. 2015 を参考に作図 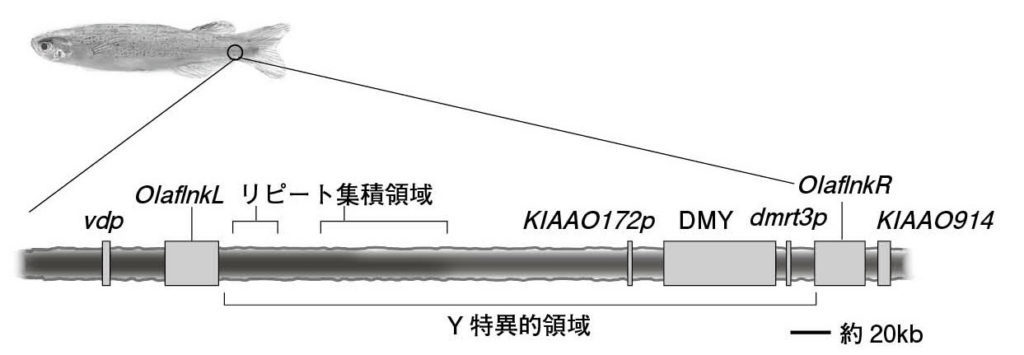
図6.メダカのY特異的領域 Dmyはオス決定遺伝子。KIAA0172pとdmrt3pは、常染色体上にある遺伝子(KIAA0172およびdmrt3)の一部しかコードしていない。 Kondo et al. 2006を参考に作図 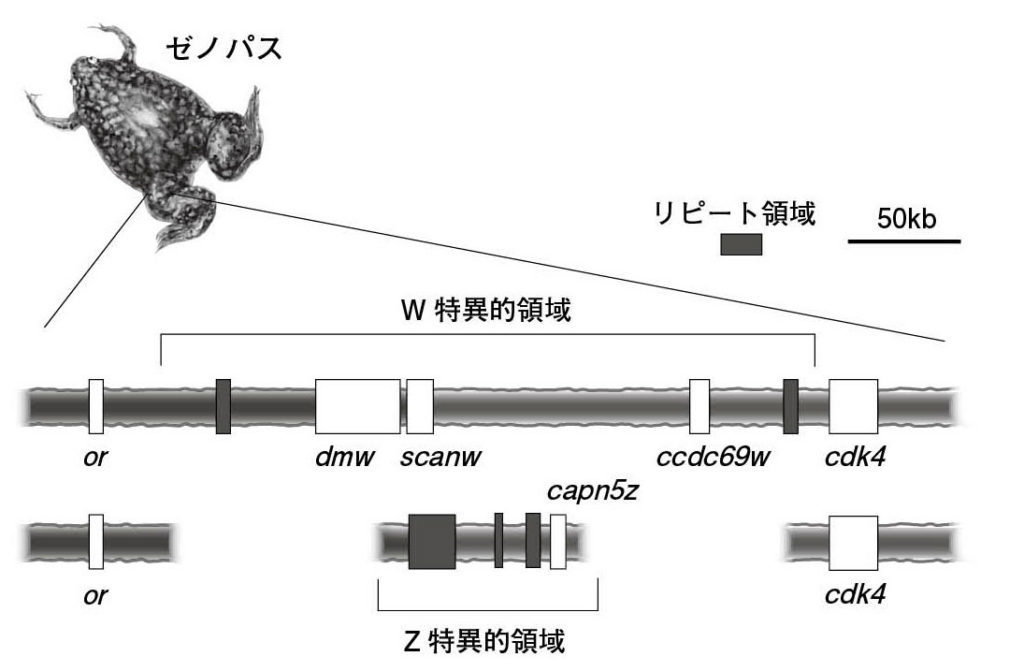
図7.ゼノパスのW特異的領域とZ特異的領域 Mawaribuchi et al., 2017を参考に作図 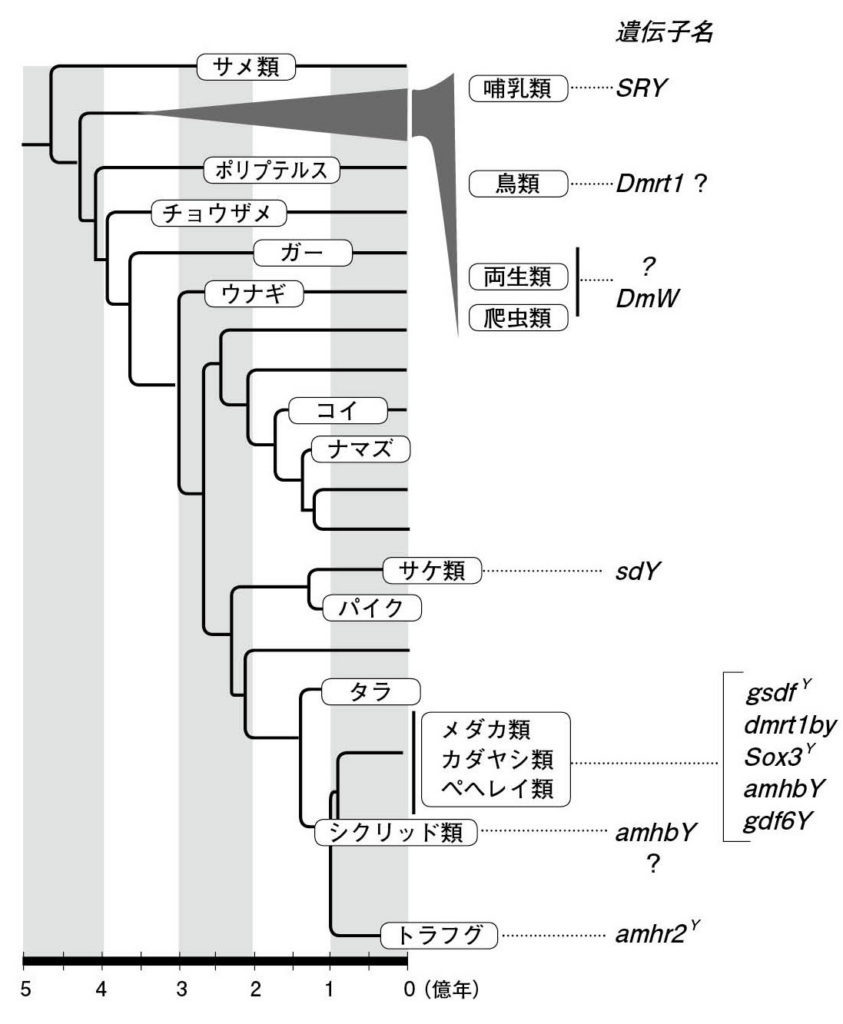
図8.脊椎動物におけるさまざまな性決定遺伝子 Pan et al., 2016を参考に作図

